题目内容
3.某无色溶液中,可大量共存的离子组是( )| A. | Na+、HCO3-、SO42-、Cl- | B. | Cu2+、NO3-、Cl-、SO42- | ||
| C. | H+、Cl-、K+、CO32- | D. | K+、Mg2+、SO42-、OH- |
分析 溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.四种离子之间不反应,都是无色离子;
B.铜离子为有色离子;
C.碳酸根离子与氢离子反应;
D.镁离子与氢氧根离子反应生成氢氧化镁沉淀.
解答 解:无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.Na+、HCO3-、SO42-、Cl-之间不发生反应,都是无色离子,在溶液中能够大量共存,故A正确;
B.Cu2+为有色离子,不满足溶液无色的条件,故B错误;
C.H+、CO32-之间发生反应,在溶液中不能大量共存,故C错误;
D.Mg2+、OH-之间反应生成难溶物氢氧化镁,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列实验所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 提取碘水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度比水中大 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 纯碱的热稳定性大于碳酸氢铵 |
| C | 分离KNO3和NaCl | 重结晶 | 硝酸钾的溶解度大于氯化钠 |
| D | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯密度大于乙醇 |
| A. | A | B. | B | C. | C | D. | D |
8.下列关于有机物结构或性质说法正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 光照条件下1mol CH4与3mol Cl2反应可制得1mol CHCl3 | |
| C. | 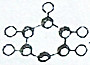 为苯分子的比例模型 为苯分子的比例模型 | |
| D. | HC≡C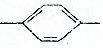 CH═CHCH3中所有碳原子有可能都在同一个平面内 CH═CHCH3中所有碳原子有可能都在同一个平面内 |
18.下列说法正确的是( )
| A. | 氢键、分子间作用力、离子键、共价键都是微粒间的作用力,其中氢键、离子键和共价键是化学键 | |
| B. | 石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 | |
| C. | H、S、O三种元素组成的物质的水溶液与Na、S、O三种元素组成的物质的水溶液混合可能会观察到浑浊现象 | |
| D. | 测定中和热的实验中,应将酸、碱溶液一次性倒入量热装置中,并不断搅拌,待温度稳定后记下温度 |
15.相同状况下,等质量的O2和CO2相比较,下列叙述正确的是( )
| A. | 体积比为8:11 | B. | 密度之比为1:1 | ||
| C. | 物质的量之比为11:8 | D. | 原子个数之比为12:11 |
12.下列有关实验原理、装置、操作或结论的描述,不正确的是(有关装置的夹持仪器略去未画)( )
| A. |  实验室用大理石与盐酸制取CO2 | B. |  制取SO2、检验SO2的漂白性 | ||
| C. |  提纯氢氧化铁胶体 | D. |  实验室用乙醇和硫酸制已烯 |
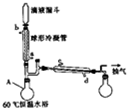 过氧乙酸常用作氧化剂和灭菌剂,实验室合成过氧乙酸并测定其含量的相关步骤如下:
过氧乙酸常用作氧化剂和灭菌剂,实验室合成过氧乙酸并测定其含量的相关步骤如下: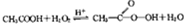
 已知4HCl(g)+O2(g) $?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
已知4HCl(g)+O2(g) $?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下: