题目内容
13.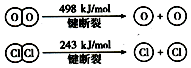 已知4HCl(g)+O2(g) $?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
已知4HCl(g)+O2(g) $?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:①4HCl(g)+O2(g)$?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)△H=-115.6KJ/mol.
②断开1mol H-O键与断开 1mol H-Cl 键所需能量相差约为32kJ,H2O中H-O 键比HCl中H-Cl键强(填“强”或“弱”).
分析 ①反应4HCl(g)+O2(g) $?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)中2mol HCl被氧化,放出57.8kJ的热量,据此可计算出4molHCl被氧化放出热量;
②焓变=反应物断键吸收热量-生成物形成化学键放出热量,据此列式计算出断开1mol H-O键与断开 1mol H-Cl 键所需能量之差;根据计算结果判断二者键能大小.
解答 解:①反应4HCl(g)+O2(g) $?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)中2mol HCl被氧化,放出57.8kJ的热量,则4molHCl被氧化放出115.6kJ热量,该反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 kJ/mol,
故答案为:-115.6;
②焓变=反应物断键吸收热量-生成物形成化学键放出热量,4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
则:4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,即:4×E(H-O)-4×E(H-Cl)=498-486+115.6=127.6,
所以E(H-O)-E(H-Cl)=31.9≈32,H2O中H-O键比HCl中H-Cl键强,
故答案为:32;强.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确反应热与键能的关系为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
3.某无色溶液中,可大量共存的离子组是( )
| A. | Na+、HCO3-、SO42-、Cl- | B. | Cu2+、NO3-、Cl-、SO42- | ||
| C. | H+、Cl-、K+、CO32- | D. | K+、Mg2+、SO42-、OH- |
1.将纯锌片和纯铜片按如图所方式插入同浓度的稀硫酸中,一段时间后,以下叙述正确的是( )

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中化学能转化成了电能 | ||
| C. | 甲中铜片是负极 | D. | 乙中铜片是正极 |
18.下列各组离子一定能在常温指定环境中大量共存的是( )
| A. | 无色溶液中:Al3+、NH4+、Cl-、HCO3- | |
| B. | 甲基橙显红色的溶液中:Fe2+、Na+、SO42-、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol•L-1的溶液:K+、HCO3-、I-、ClO- | |
| D. | pH值为1的溶液:Fe2+、Cl-、Na+、SCN- |
5.用NA表示阿伏加德罗常致,下列说法正确的是( )
| A. | 将lmol Cl2溶于水,所得溶液中HClO、Cl-和C1O-的总数目为2NA | |
| B. | 46g NO2和N2O4混合物中含分子数为NA | |
| C. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA | |
| D. | 适量Na2O2与CO2反应生成1mol O2时,转移的电子数为2NA |
2.微粒用${\;}_{Z}^{A}$Rn+表示,下列关于该微粒的叙述正确的是( )
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A+Z |
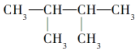 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;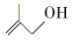 的分子式为C4H8O;
的分子式为C4H8O;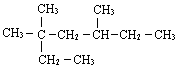 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 2,3-二甲基1-丁烯
2,3-二甲基1-丁烯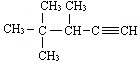 的系统名称为3,4,4-三甲基-1-戊炔
的系统名称为3,4,4-三甲基-1-戊炔 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.