题目内容
下列说法正确的是( )
| A、增大压强,使活化分子数目增加,化学反应速率一定增大 |
| B、活化分子间所发生的分子间碰撞均为有效碰撞 |
| C、升高温度,使活化分子百分数增加,化学反应速率一定增大 |
| D、加入反应物,使活化分子百分数增加,化学反应速率一定增大 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:升高温度、加入催化剂,可增大活化分子的百分数,反应速率增大,增大浓度、压强,可增大单位体积活化分子的数目,发生化学反应的碰撞为有效碰撞,以此解答该题.
解答:
解:A.增大压强,单位体积的活化分子数目增加,活化分子总数不一定增大,故A错误;
B.活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞,故B错误;
C.升高温度,活化分子百分数增加,化学反应速率一定能够增大,故C正确;
D.加入反应物,活化分子百分数不变,但活化分子总数增加,化学反应速率增大,故D错误.
故选C.
B.活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞,故B错误;
C.升高温度,活化分子百分数增加,化学反应速率一定能够增大,故C正确;
D.加入反应物,活化分子百分数不变,但活化分子总数增加,化学反应速率增大,故D错误.
故选C.
点评:本题考查化学反应速率的影响因素,侧重于基本概念的理解和应用,为高考常见题型和高频考点,难度不大,注意相关基础知识的积累.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
下列反应属于吸热反应的是( )
| A、盐酸和氢氧化钠溶液之间的中和反应 | ||||
B、CO2+C
| ||||
C、金属镁燃烧:2Mg+O2
| ||||
| D、生石灰溶于水:CaO+H2O=Ca(OH)2 |
下列变化中,需要加入还原剂才能实现的( )
| A、Cl-→Cl2 |
| B、FeCl3→FeCl2 |
| C、CaCO3→CO2 |
| D、KMnO4→MnO2 |
某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
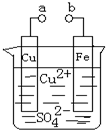

| A、a和b不连接时,铁片上会有金属铜析出 |
| B、a和b用导线连接时,溶液中的SO42-向铁电极移动,铜片上发生的反应为:Cu2++2e-=Cu |
| C、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D、a和b分别连接直流电源正、负极,溶液中的Cu2+向铜电极移动 |
有关热化学方程式书写与对应表述均正确的是( )
| A、稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1 |
| B、在101KPa下氢气的标准燃烧热△H=-285.5 kJ?mol-1,则水分解的热化学方程式 2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ?mol-1 |
| C、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量. 则Fe(s)+S(s)=FeS(s)△H=-95.6 kJ?mol-1 |
| D、已知2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,则可知C的标准燃烧热为110.5 kJ?mol-1 |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、78gNa2O2固体中含有的阴离子数为NA |
| B、标准状况下,2.24L氖气所含原子数为0.2NA |
| C、1molCl2与足量Fe反应,转移的电子数为3NA |
| D、标准状况下,2.24L已烷含有碳原子的数目为0.6NA |