题目内容
下列变化中,需要加入还原剂才能实现的( )
| A、Cl-→Cl2 |
| B、FeCl3→FeCl2 |
| C、CaCO3→CO2 |
| D、KMnO4→MnO2 |
考点:氧化还原反应
专题:
分析:需要加入还原剂才能实现,则选项中为氧化剂的还原反应,氧化剂中某元素的化合价降低,以此来解答.
解答:
解:A.Cl元素的化合价升高,需要加氧化剂,故A不选;
B.Fe元素的化合价降低,需要加还原剂,故B选;
C.没有元素的化合价变化,不发生氧化还原反应,故C不选;
D.Mn元素的化合价降低,但可发生自身氧化还原反应,故D不选;
故选B.
B.Fe元素的化合价降低,需要加还原剂,故B选;
C.没有元素的化合价变化,不发生氧化还原反应,故C不选;
D.Mn元素的化合价降低,但可发生自身氧化还原反应,故D不选;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化与还原反应的考查,注意从元素化合价的角度分析,选项D为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
水的电离平衡曲线如图所示,下列说法正确的是( )
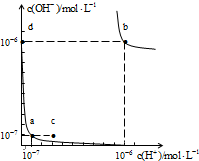

| A、图中对应点的温度关系为:a>b |
| B、水的离子积常数Kw数值大小关系为:b>d |
| C、温度不变,加入少量NaOH可使溶液从a点变到c点 |
| D、在b点对应的温度下,pH=6的溶液显酸性 |
可逆反应:2A(g)+B(g)?3C(g)+D(g).试根据如图判断正确的是( )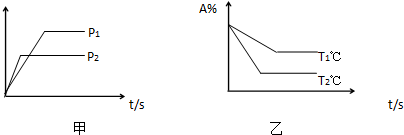

| A、温度T1℃比 T2℃高 |
| B、正反应为放热反应 |
| C、甲图纵轴可以表示A的转化率 |
| D、甲图纵轴可以表示混合气体平均相对分子质量 |
下列说法正确的是( )
| A、增大压强,使活化分子数目增加,化学反应速率一定增大 |
| B、活化分子间所发生的分子间碰撞均为有效碰撞 |
| C、升高温度,使活化分子百分数增加,化学反应速率一定增大 |
| D、加入反应物,使活化分子百分数增加,化学反应速率一定增大 |
下列四类反应:①置换反应 ②复分解反应 ③只有一种元素化合价发生变化的反应 ④离子反应,其中一定不是氧化还原反应的是( )
| A、只有② | B、只有③ |
| C、只有②④ | D、①②③④ |
关于下列各装置图的叙述中,不正确的是( )
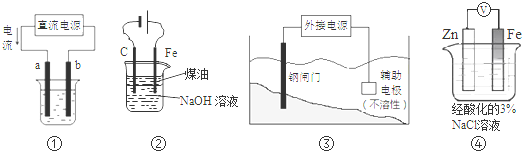

| A、用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B、用图②装置实验室制备白色Fe(OH)2 |
| C、装置③中钢闸门应与外接电源的正极相连 |
| D、装置④中电子由Zn流向Fe,Zn极发生氧化反应 |
某氧化物的化学式为R2O3,电子总数为50,已知氧原子核内有8个中子,R2O3的相对分子质量为102,则R原子核内中子数为( )
| A、10 | B、12 | C、14 | D、21 |
下列叙述正确的是( )
| A、一定温度、压强下,固体的体积只由其分子的大小决定 |
| B、一定温度、压强下,气体体积由其物质的量的多少决定 |
| C、等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度相等 |
| D、气体摩尔体积是指1mol任何气体所占的体积为22.4L |