题目内容
某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
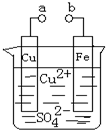

| A、a和b不连接时,铁片上会有金属铜析出 |
| B、a和b用导线连接时,溶液中的SO42-向铁电极移动,铜片上发生的反应为:Cu2++2e-=Cu |
| C、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D、a和b分别连接直流电源正、负极,溶液中的Cu2+向铜电极移动 |
考点:原电池和电解池的工作原理
专题:
分析:A.a和b不连接时,铁和铜离子发生置换反应;
B.a和b连接时,该装置构成原电池,铁易失电子作负极,铜作正极,正极上铜离子得电子发生还原反应;
C.无论a和b是否连接,铁都可以发生反应;
D.电解池中,阳离子向阴极移动.
B.a和b连接时,该装置构成原电池,铁易失电子作负极,铜作正极,正极上铜离子得电子发生还原反应;
C.无论a和b是否连接,铁都可以发生反应;
D.电解池中,阳离子向阴极移动.
解答:
解:A.a和b不连接时,铁和铜离子发生置换反应,所以铁片上有铜析出,故A正确;
B.a和b连接时,该装置构成原电池,铁作负极,铜作正极,正极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,故B正确;
C.无论a和b是否连接,铁都失电子发生氧化反应,所以铁都溶解,故C正确;
D.a和b分别连接直流电源正、负极时,该装置构成电解池,铁作阴极,铜作阳极,铜离子向阴极(铁电极)移动,故D错误;
故选D.
B.a和b连接时,该装置构成原电池,铁作负极,铜作正极,正极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,故B正确;
C.无论a和b是否连接,铁都失电子发生氧化反应,所以铁都溶解,故C正确;
D.a和b分别连接直流电源正、负极时,该装置构成电解池,铁作阴极,铜作阳极,铜离子向阴极(铁电极)移动,故D错误;
故选D.
点评:本题考查了原电池和电解池原理,明确正负极的判断方法、电极反应类型、阴阳离子移动方向即可解答,难度不大,易错点为阴阳离子移动方向的判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用价层电子互斥理论模型预测下列粒子的立体结构是三角锥形的是( )
| A、PCl3 |
| B、BeCl2 |
| C、NH4+ |
| D、SO3 |
25℃时,NH4Cl和NH3?H2O混合溶液的pH为7,则该溶液呈( )
| A、酸性 | B、碱性 |
| C、中性 | D、无法确定 |
下列说法正确的是( )
| A、增大压强,使活化分子数目增加,化学反应速率一定增大 |
| B、活化分子间所发生的分子间碰撞均为有效碰撞 |
| C、升高温度,使活化分子百分数增加,化学反应速率一定增大 |
| D、加入反应物,使活化分子百分数增加,化学反应速率一定增大 |
在3S+6KOH=2K2S+K2SO3+3H2O这个反应中,被氧化与被还原的S原子个数比( )
| A、1:2 | B、2:1 |
| C、1:1 | D、3:1 |
关于下列各装置图的叙述中,不正确的是( )
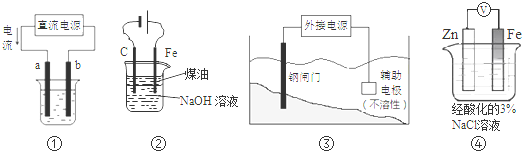

| A、用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B、用图②装置实验室制备白色Fe(OH)2 |
| C、装置③中钢闸门应与外接电源的正极相连 |
| D、装置④中电子由Zn流向Fe,Zn极发生氧化反应 |
用高铁酸钠(Na2FeO4)对河(湖)水消毒是城市饮水处理的新技术.已知反应:Fe2O3+3Na2O2
2Na2FeO4+Na2O,下列说法正确的是( )
| ||
| A、Na2O2既是氧化剂又是还原剂 |
| B、3 mol Na2O2发生反应,有6mol电子转移 |
| C、在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| D、Na2FeO4既是氧化产物又是还原产物 |