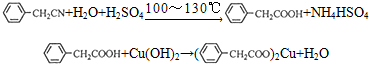题目内容
20.能正确表示下列化学反应的离子方程式是( )| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 向硝酸银溶液中加盐酸:Ag++C1-═AgCl↓ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 氢氧化钡溶液与硫酸的反应 OH-+H+=H2O |
分析 A.澄清的石灰水中氢氧化钙应拆成离子形式;
B.二者反应实质氯离子与银离子反应生成氯化银;
C.电荷不守恒;
D.漏掉钡离子与硫酸根离子的反应;
解答 解:A.澄清的石灰水与稀盐酸反应,离子方程式:OH-+H+=H2O,故A错误;
B.向硝酸银溶液中加盐酸,离子方程式:Ag++C1-═AgCl↓,故B正确;
C.铜片插入硝酸银溶液中,离子方程式:Cu+2Ag+=Cu2++2Ag,故C错误;
D.氢氧化钡溶液与硫酸的反应 Ba2++SO42-+2H++2OH-═Ba SO4↓+2H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实,遵循原子个数守恒规律,注意化学式的拆分,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.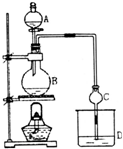 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式CH3CO18OH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H218O;
(2)球形干燥管C的作用是防止倒吸、冷凝.D中饱和碳酸钠溶液的作用是:乙酸乙酯与饱和Na2CO3溶液不互溶、且密度有较大差异,有利于分层,饱和Na2CO3溶液还可以吸收挥发出来的乙酸和乙醇若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示):反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇;再加入C(A.五氧化二磷、B.碱石灰、C.无水硫酸钠、D.生石灰),再加热进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是制乙酸、催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式CH3CO18OH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H218O;
(2)球形干燥管C的作用是防止倒吸、冷凝.D中饱和碳酸钠溶液的作用是:乙酸乙酯与饱和Na2CO3溶液不互溶、且密度有较大差异,有利于分层,饱和Na2CO3溶液还可以吸收挥发出来的乙酸和乙醇若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是CO32-+H2O?HCO3-+OH-(用离子方程式表示):反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇;再加入C(A.五氧化二磷、B.碱石灰、C.无水硫酸钠、D.生石灰),再加热进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
11.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | 1molCO 完全燃烧,放出热量为 283 J | |
| B. | Na2O2(s)+CO2(s)=Na2CO3(s)+$\frac{1}{2}$ O2(g)△H=-226 kJ•mol-1 | |
| C. | CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 1.204×1024 | |
| D. | CO 的燃烧热为 566 kJ•mol-1 |
8.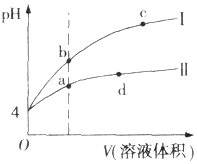 常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
 常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | pH=4的HCl溶液中H2O电离出的c(H+)=10-4 mol.L-1 | |
| B. | 曲线I为CH3COOH溶液的稀释曲线 | |
| C. | a、d点溶液和NaOH溶液完全反应时消耗的NaOH的物质的量相等 | |
| D. | a、b、c三点溶液中Kw:c=b<a |
5.下列说法不正确的是( )
| A. | 油脂是高级脂肪酸和甘油生成的酯 | |
| B. | 米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
12.下列叙述中,不能用平衡移动原理解释的是( )
| A. | 红棕色的NO2气体,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 氯气在水中溶解度大于饱和食盐水中的溶解度 | |
| D. | 由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深 |
9.下列各组物质中,所含分子数不相同的是( )
| A. | 10g H2 和10g O2 | B. | 5.6L N2(标准状况)和11g CO2 | ||
| C. | 9g H2O 和0.5mol Br2D | D. | 224mLH2 (标准状况)和0.01mol N2 |
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,下面是它的一种实验室合成路线: