题目内容
5.下列说法不正确的是( )| A. | 油脂是高级脂肪酸和甘油生成的酯 | |
| B. | 米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
分析 A.油脂为高级脂肪酸甘油酯;
B.淀粉在唾液淀粉酶作用下生成麦芽糖;
C.乙醇不是人体必要的营养物质;
D.水果中含有脂类物质.
解答 解:A.油脂为高级脂肪酸甘油酯,可水解生成高级脂肪酸和甘油,故A正确;
B.淀粉在唾液淀粉酶作用下生成麦芽糖,具有甜味,故B正确;
C.乙醇不是人体必要的营养物质,故C错误;
D.水果中含有脂类物质,具有香味,故D正确.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.下列说法中正确的是( )
| A. | 标准状况下,22.4L水中所含的分子数约为6.02×1023 | |
| B. | 标准状况下,aL的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| C. | 常温常压下,48g O3气体含有的氧原子数为6.02×1023 | |
| D. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
16.下列说法正确的是( )
| A. | 同一物质的固、液、气三种状态的熵值相同 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g);△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
13.298K时,合成氨反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,在该温度下,取1mol N2和3mol H2放在密闭容器内反应.下列说法正确的是( )
| A. | 反应放出的热量始终小于92.4 kJ | |
| B. | 有无催化剂该反应放出的热量都为92.4 kJ | |
| C. | 在有催化剂存在的条件下,反应放出的热量为92.4 kJ | |
| D. | 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ |
20.能正确表示下列化学反应的离子方程式是( )
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 向硝酸银溶液中加盐酸:Ag++C1-═AgCl↓ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 氢氧化钡溶液与硫酸的反应 OH-+H+=H2O |
10.下列生活习惯比较健康和科学的是( )
| A. | 新装修的房子应该开窗、通风一段时间后再入住 | |
| B. | 制作家具用的固化剂等化学试剂越多越好 | |
| C. | 饮用的水越纯净越健康 | |
| D. | 旧电池已不能使用,不需要回收 |
17.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状态下,33.6L三氧化硫中含有硫原子的数目为1.5 NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA | |
| C. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
16.日本的核泄漏引起了人们对核能的恐慌,也加剧了人类对化石燃料的依赖,化石燃料特别是煤的使用不当会加剧环境污染,工业上常把煤进行汽化、液化处理,使煤变成清洁能源.煤的一种转化流程图如下:
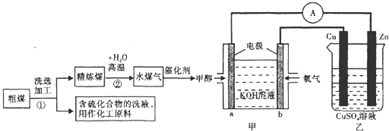
(1)随着反应的进行,乙池的电解质溶液的pH不变(填“增大、减小、不变”);甲池中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H═-442.8kJ/mol
(3)C(s)和H2O(g)在一定条件下反应可得一H2等清洁燃料.将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),不同温度下得到三组数据:
①实验2条件下平衡常数K=0.75;若实验2中分离出1mol H2O(g),则H2O(g)的转化率将增大(填“增大、减小、不变”)
②若实验3起始时充入的是CO(g)和H2(g),且达平衡时实验2、3中CO的体积分数相同,则起始时c(H2)=1.5mol/L.

(1)随着反应的进行,乙池的电解质溶液的pH不变(填“增大、减小、不变”);甲池中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1451.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H═-442.8kJ/mol
(3)C(s)和H2O(g)在一定条件下反应可得一H2等清洁燃料.将不同量的C(s)和H2O(g)分别加入到体积为2L的恒容密闭容器中发生反应:C(s)+H2O(g)?CO(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
②若实验3起始时充入的是CO(g)和H2(g),且达平衡时实验2、3中CO的体积分数相同,则起始时c(H2)=1.5mol/L.