题目内容
11.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-12Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | 1molCO 完全燃烧,放出热量为 283 J | |
| B. | Na2O2(s)+CO2(s)=Na2CO3(s)+$\frac{1}{2}$ O2(g)△H=-226 kJ•mol-1 | |
| C. | CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 1.204×1024 | |
| D. | CO 的燃烧热为 566 kJ•mol-1 |
分析 A、放出热量的单位为KJ;
B、根据焓变与系数成正比计算;
C、CO(g)与 Na2O2(s)反应未指明生成物的状态;
D、依据燃烧热的概念即1mol可燃物完全燃烧生成稳定氧化物时放出的热量分析计算判断.
解答 解;A、根据2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1,则1molCO 完全燃烧,放出热量为283KJ,故A错误;
B、已知:2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ•mol-1,则Na2O2(s)+CO2(s)=Na2CO3(s)+$\frac{1}{2}$ O2(g)△H=-226 kJ•mol-1,故B正确;
C、已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol ②2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452kJ•mol-1,根据盖斯定律合并热化学方程式得到,$\frac{②+①}{2}$得到的热化学方程式为 CO(g)+Na2O2(s)=Na2CO3(s);△H=-509kJ/mol,电子转移数为2mol即1.204×1024,但CO(g)与 Na2O2(s)反应未指明生成物的状态,故C错误;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,又2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1,所以CO的燃烧热为283kJ/mol,故D错误;
故选B.
点评 本题考查了热化学方程式的书写判断,燃烧热的概念应用,反应焓变的意义,盖斯定律的应用.

练习册系列答案
相关题目
2.关于苯的下列说法中不正确的是( )
| A. | 组成苯的12个原子在同一平面上 | |
| B. | 苯环中6个碳碳键键长完全相同 | |
| C. | 苯的密度比水的小 | |
| D. | 苯只能发生取代反应,不能发生加成反应 |
19.在同温同压下,A容器中的氧气和B容器中的氨所含的原子个数相同时,则A、B两容器中气体体积之比为( )
| A. | 1:2 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
6.下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
| A. | 高锰酸钾、硫酸铜、澄清石灰水 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、空气、熟石灰 | D. | 硝酸、食盐水、烧碱 |
16.下列说法正确的是( )
| A. | 同一物质的固、液、气三种状态的熵值相同 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g);△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
20.能正确表示下列化学反应的离子方程式是( )
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 向硝酸银溶液中加盐酸:Ag++C1-═AgCl↓ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 氢氧化钡溶液与硫酸的反应 OH-+H+=H2O |
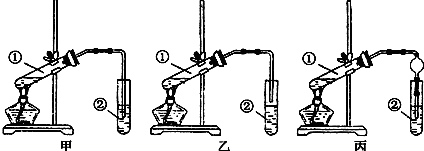
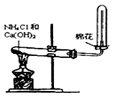
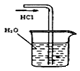
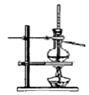
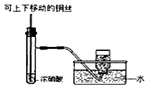
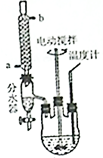 某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下:
某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下: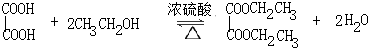 .
.