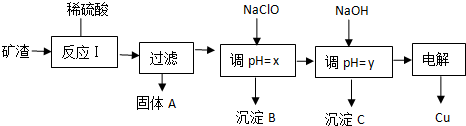
题目内容
在强碱性溶液中能大量共存的离子组是( )
| A、Na+、NH4+、H+、NO3- |
| B、K+、Ca2+、HCO3-、NO3- |
| C、Na+、Mg2+、Cl-、NO3- |
| D、Na+、Ba2+、NO3-、Cl- |
考点:离子共存问题
专题:
分析:碱性溶液中存在大量氢氧根离子,与氢氧根离子反应的离子不能大量共存,
A.铵根离子、氢离子与氢氧根离子反应;
B.碳酸氢根离子、钙离子与氢氧根离子反应生成碳酸钙沉淀;
C.镁离子与氢氧根离子反应生成难溶物氢氧化镁;
D.Na+、Ba2+、NO3-、Cl-离子之间不满足离子反应发生条件,都不与氢氧根离子反应.
A.铵根离子、氢离子与氢氧根离子反应;
B.碳酸氢根离子、钙离子与氢氧根离子反应生成碳酸钙沉淀;
C.镁离子与氢氧根离子反应生成难溶物氢氧化镁;
D.Na+、Ba2+、NO3-、Cl-离子之间不满足离子反应发生条件,都不与氢氧根离子反应.
解答:
解:A.NH4+、H+离子与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.Ca2+、HCO3-与氢氧根离子反应生成碳酸钙沉淀,在溶液中不能大量共存,故B错误;
C.Mg2+与氢氧根离子反应生成氢氧化镁沉淀,在溶液中不能大量共存,故C错误;
D.Na+、Ba2+、NO3-、Cl-离子之间不发生反应,且都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
B.Ca2+、HCO3-与氢氧根离子反应生成碳酸钙沉淀,在溶液中不能大量共存,故B错误;
C.Mg2+与氢氧根离子反应生成氢氧化镁沉淀,在溶液中不能大量共存,故C错误;
D.Na+、Ba2+、NO3-、Cl-离子之间不发生反应,且都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评:本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
下列按混合物、纯净物、电解质和非电解质顺序排列的是( )
| A、盐酸、空气、醋酸、干冰 |
| B、漂白粉、胆矾、氯化钾、硫酸钡 |
| C、蛋白质、油脂、苛性钾、碳酸钙 |
| D、福尔马林、冰醋酸、硫酸钠、乙醇 |
下列叙述不正确的是( )
| A、碳酸钙能够溶解在二氧化碳的水溶液中 |
| B、氢氧化镁可溶于盐酸不溶于氯化铵溶液 |
| C、氯化银可溶于氨水 |
| D、硫酸镁溶液中滴加氢氧化钡得到两种沉淀 |
用于净化汽车尾气的反应:2NO(g)+2CO(g)?2CO2(g)+N2(g),已知该反应在570K时几乎完全反应,但反应速率极慢.下列说法正确的是( )
| A、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B、提高尾气净化效率的常用方法是升高温度 |
| C、增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |
| D、提高尾气净化效率的最佳途径是使用高效催化剂 |
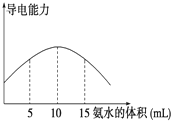 电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )| A、0.5% | B、1.5% |
| C、0.1% | D、1% |
有M、N两种溶液,各含有下列12种离子中的6种,且所含离子各不相同:Al3+、Na+、K+、Cl-、NO3-、OH-、Fe3+、Ba2+、H+、SO32-、MnO4-、AlO2-.已知每组溶液中的阳离子至少有2种,则下列说法正确的是( )
| A、若溶液M呈强酸性,则N中一定含有OH-、NO3- |
| B、若溶液N呈强酸性,则N中一定含有Al3+、可能含有Na+ |
| C、若溶液N无色,则N中一定不含有Fe3+、Cl-,且溶液M有强氧化性 |
| D、常温下,若M、N两溶液混合后pH=7,则至少生成三种沉淀 |
下列说法正确的是( )
| A、分子晶体中一定不含离子键,但一定存在共价键 |
| B、金属与非金属元素形成的化合物一定是离子化合物 |
| C、NCl3分子中所有的原子均为8电子稳定结构 |
| D、NaHSO4晶体中阴、阳离子的个数比是1:2 |