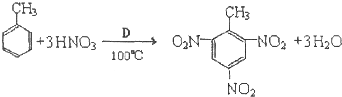
题目内容
用于净化汽车尾气的反应:2NO(g)+2CO(g)?2CO2(g)+N2(g),已知该反应在570K时几乎完全反应,但反应速率极慢.下列说法正确的是( )
| A、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B、提高尾气净化效率的常用方法是升高温度 |
| C、增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |
| D、提高尾气净化效率的最佳途径是使用高效催化剂 |
考点:化学平衡的影响因素
专题:
分析:A、反应是可逆反应,不能进行彻底;
B、尾气温度已经很高,再升高温度的意义不大;
C、从平衡常数分析反应进行程度,净化设备经济效益分析;
D、提高净化速率的最好方法是使用高效催化剂.
B、尾气温度已经很高,再升高温度的意义不大;
C、从平衡常数分析反应进行程度,净化设备经济效益分析;
D、提高净化速率的最好方法是使用高效催化剂.
解答:
解:A、该反应为可逆反应,不能完全转化,排出的气体中一定含有NO或CO,故A错误;
B、尾气温度已经很高,再升高温度,反应速率提高有限,且消耗更多能源,意义不大,故B错误;
C、因平衡常数已经较大,增大压强虽然平衡正向移动,但对设备要求更高,不符合生成经济效益,故C错误;
D、研制高效催化剂可提高反应速率,解决反应极慢的问题,有利于尾气的转化,故D正确;
故选D.
B、尾气温度已经很高,再升高温度,反应速率提高有限,且消耗更多能源,意义不大,故B错误;
C、因平衡常数已经较大,增大压强虽然平衡正向移动,但对设备要求更高,不符合生成经济效益,故C错误;
D、研制高效催化剂可提高反应速率,解决反应极慢的问题,有利于尾气的转化,故D正确;
故选D.
点评:本题考查化学反应速率问题,题目难度不大,注意把握题给信息,为解答该题的关键,答题时注意认真审题.

练习册系列答案
相关题目
下列各溶液中,Na+浓度最大的是( )
| A、1L0.5mol/L的NaOH溶液 |
| B、2L0.4mol/L的NaNO3溶液 |
| C、3L0.3mol/L的NaCl溶液 |
| D、4L0.2mol/L的Na3PO4溶液 |
下列有关硅酸盐的说法错误的是( )
| A、硅酸盐的种类很多,结构也很复杂,通常可用二氧化硅和金属氧化物的形式来表示其组成 |
| B、硅酸盐岩石长期在水的侵蚀下,风化为黏土,并且形成土壤胶体 |
| C、水玻璃长期暴露在空气中会变质这是因为水玻璃主要发生了氧化还原反应 |
| D、传统无机非金属材料的优缺点,抗腐蚀耐高温质脆经不起冲击 |
在强碱性溶液中能大量共存的离子组是( )
| A、Na+、NH4+、H+、NO3- |
| B、K+、Ca2+、HCO3-、NO3- |
| C、Na+、Mg2+、Cl-、NO3- |
| D、Na+、Ba2+、NO3-、Cl- |
在溶液中能大量共存,加入OH-有沉淀析出,加入H+有气体放出的是( )
| A、Na+、Cu2+、Cl-、SO42- |
| B、Fe3+、K+、SO42-、NO3- |
| C、Zn2+、Mg2+、HSO3-、SO42- |
| D、Na+、Ca2+、Cl-、HCO3- |

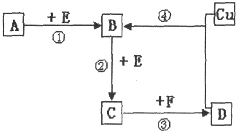 A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题:
A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题: