题目内容
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
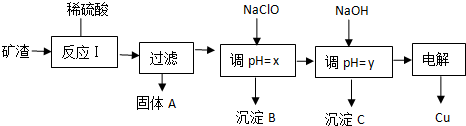
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)反应I中如果Cu2O与Fe2O3之间恰好完全反应,则发生反应的化学方程式为:
(2)用NaClO调pH=x是此工艺流程中的最佳选择.
①选择NaClO的理由是:
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为:
(3)测定pH=y的仪器是
(4)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol?L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为 .(已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20)
(5)电解初期阳极的电极反应式为 .

已知:Cu2O+2H+=Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)用NaClO调pH=x是此工艺流程中的最佳选择.
①选择NaClO的理由是:
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为:
(3)测定pH=y的仪器是
(4)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol?L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为
(5)电解初期阳极的电极反应式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:矿渣加入稀硫酸氧化亚铜、氧化铝、氧化铁溶解,二氧化硅不溶所以固体混合物是不溶于稀硫酸的物质,根据反应:Cu2O+2H+=Cu+Cu2++H2O,得出A的成分是SiO2、Cu;由于单质铜存在,铁元素以Fe2+形式存在,反应方程式:2Fe3++Cu=Cu2++2Fe2+,滤液中主要是Al3+、Fe2+、Cu2+,加入NaClO具有氧化性,氧化亚铁离子为铁离子,同时调节溶液PH使铁离子、铝离子沉淀完全,根据氢氧化铁和氢氧化铝开始沉淀和沉淀结束的PH关系,x范围是:3.2≤pH<4.0,目的是沉淀氢氧化铁;y范围是:5.2≤pH<5.4,沉淀氢氧化铝;最后得到氯化铜、硫酸铜溶液,电解法获取Cu时,阴极发生还原反应:Cu2++2e-=Cu;阳极发生氧化反应:2Cl--2e-=Cl2↑;次氯酸钠中的次氯酸根结合溶液中的氢离子,PH升高;NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的;溶液显示酸性,次氯酸是弱酸,次氯酸根结合酸溶液中的氢离子;生成一种具有漂白作用的物质是次氯酸.
解答:
解:矿渣加入稀硫酸氧化亚铜、氧化铝、氧化铁溶解,二氧化硅不溶所以固体混合物是不溶于稀硫酸的物质,根据反应:Cu2O+2H+=Cu+Cu2++H2O,得出A的成分是SiO2、Cu;由于单质铜存在,铁元素以Fe2+形式存在,反应方程式:2Fe3++Cu=Cu2++2Fe2+,滤液中主要是Al3+、Fe2+、Cu2+,加入NaClO具有氧化性,氧化亚铁离子为铁离子,同时调节溶液PH使铁离子、铝离子沉淀完全,根据氢氧化铁和氢氧化铝开始沉淀和沉淀结束的PH关系,x范围目的是沉淀氢氧化铁;y范围目的是沉淀氢氧化铝;最后得到氯化铜、硫酸铜溶液,电解法获取Cu时,阴极发生还原反应:Cu2++2e-=Cu;阳极发生氧化反应:2Cl--2e-=Cl2↑;次氯酸钠中的次氯酸根结合溶液中的氢离子,PH升高;NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的;溶液显示酸性,次氯酸是弱酸,次氯酸根结合酸溶液中的氢离子;生成一种具有漂白作用的物质是次氯酸;
(1)反应I中如果Cu2O与Fe2O3之间恰好发生氧化还原反应硫酸溶液中生成硫酸铜、硫酸亚铁、水,反应的化学方程式为Cu2O+Fe2O3+4H2SO4=2CuSO4+2FeSO4+4H2O,故答案为:Cu2O+Fe2O3+4H2SO4=2CuSO4+2FeSO4+4H2O;
(2)①次氯酸钠中的次氯酸根结合溶液中的氢离子,PH升高;NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的;
故答案为:NaClO由于发生反应ClO-+H+?HClO,ClO-消耗了氢离子,溶液PH升高,ClO-具有氧化性可以氧化亚铁离子为铁离子;
②根据氢氧化铁和氢氧化铝开始沉淀和沉淀结束的PH关系,x范围目的是沉淀氢氧化铁;y范围目的是沉淀氢氧化铝,生成沉淀B为氢氧化铁,同时生成一种具有漂白作用的物质为次氯酸,反应的离子方程式2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO,
故答案为:2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO;
(3)由表格中pH的数值可知,pH测定较准确,则测定的仪器为pH计,故答案为:pH计;
(4)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol?L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,c(Cu2+)=2×10-4mol/L依据溶度积常数计算得到氢氧根离子浓度得到溶液PH,常温下,Cu(OH)2的溶度积常数Ksp=c(Cu2+)c2(OH-)=2×10-20,c(OH)=
=10-8mol/L;c(H+)=
=10-6mol/L,pH=6,故答案为:6;
(5)电解法获取Cu时,阴极发生还原反应:Cu2++2e-=Cu;阳极发生氧化反应:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑.
(1)反应I中如果Cu2O与Fe2O3之间恰好发生氧化还原反应硫酸溶液中生成硫酸铜、硫酸亚铁、水,反应的化学方程式为Cu2O+Fe2O3+4H2SO4=2CuSO4+2FeSO4+4H2O,故答案为:Cu2O+Fe2O3+4H2SO4=2CuSO4+2FeSO4+4H2O;
(2)①次氯酸钠中的次氯酸根结合溶液中的氢离子,PH升高;NaClO能调节pH的主要原因是由于发生反应ClO-+H+?HClO,ClO-消耗H+,从而达到调节pH的目的;
故答案为:NaClO由于发生反应ClO-+H+?HClO,ClO-消耗了氢离子,溶液PH升高,ClO-具有氧化性可以氧化亚铁离子为铁离子;
②根据氢氧化铁和氢氧化铝开始沉淀和沉淀结束的PH关系,x范围目的是沉淀氢氧化铁;y范围目的是沉淀氢氧化铝,生成沉淀B为氢氧化铁,同时生成一种具有漂白作用的物质为次氯酸,反应的离子方程式2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO,
故答案为:2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO;
(3)由表格中pH的数值可知,pH测定较准确,则测定的仪器为pH计,故答案为:pH计;
(4)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol?L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,c(Cu2+)=2×10-4mol/L依据溶度积常数计算得到氢氧根离子浓度得到溶液PH,常温下,Cu(OH)2的溶度积常数Ksp=c(Cu2+)c2(OH-)=2×10-20,c(OH)=
|
| 10-14 |
| 10-8 |
(5)电解法获取Cu时,阴极发生还原反应:Cu2++2e-=Cu;阳极发生氧化反应:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑.
点评:本题考查了金属回收和环境保护方法,流程分析判断和物质性质分析,掌握物质性质和题干信息是关键,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
在强碱性溶液中能大量共存的离子组是( )
| A、Na+、NH4+、H+、NO3- |
| B、K+、Ca2+、HCO3-、NO3- |
| C、Na+、Mg2+、Cl-、NO3- |
| D、Na+、Ba2+、NO3-、Cl- |
 一定温度压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
一定温度压强下,用m g的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )| A、气球B中装的是O2 |
| B、气球A和气球C中气体分子数相等 |
| C、气球A和气球D中气体物质的量之比为4:1 |
| D、气球C和气球D中气体密度之比为2:1 |
在溶液中能大量共存,加入OH-有沉淀析出,加入H+有气体放出的是( )
| A、Na+、Cu2+、Cl-、SO42- |
| B、Fe3+、K+、SO42-、NO3- |
| C、Zn2+、Mg2+、HSO3-、SO42- |
| D、Na+、Ca2+、Cl-、HCO3- |
下列叙述错误的是( )
| A、酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 |
| B、只含有一种元素的物质不一定都是纯净物 |
| C、电离产生H+的化合物叫酸,其分子中氢原子的个数即是该酸的元数 |
| D、压强恒定时,气体在水中的溶解度随温度的升高而降低 |