题目内容
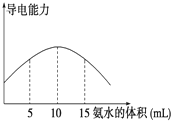 电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )| A、0.5% | B、1.5% |
| C、0.1% | D、1% |
考点:电解质溶液的导电性
专题:
分析:根据图象分析,当氨水的体积为10ml时导电性最强,说明刚好与醋酸完全反应,所以醋酸的浓度为:
=0.1mol?L-1,再根据pH=3的 CH3COOH溶液,则氢离子浓度为:10-3mol?L-1,所以CH3COOH的电离度为=(已电离的电解质的物质的量/原来总的物质的量)×100%进行计算;
| 0.2×10 |
| 20 |
解答:
解:根据图象分析,当氨水的体积为10ml时导电性最强,说明刚好与醋酸完全反应,所以醋酸的浓度为:
=0.1mol?L-1,再根据pH=3的 CH3COOH溶液,则氢离子浓度为:10-3mol?L-1,所以CH3COOH的电离度为
×100%=1%,故选:D;
| 0.2×10 |
| 20 |
| 10 -3 |
| 0.1 |
点评:主要考查了醋酸的电离度的计算,关键抓住导电性最强说明刚好完全反应进行计算即可,难度不大;

练习册系列答案
相关题目
下列各组物质的分类中,不符合前者为混合物、后者为单质的是( )
| A、矿泉水、液氮 |
| B、Na2CO3?10H2O、金刚石 |
| C、石油、液氢 |
| D、碘酒、水银 |
在强碱性溶液中能大量共存的离子组是( )
| A、Na+、NH4+、H+、NO3- |
| B、K+、Ca2+、HCO3-、NO3- |
| C、Na+、Mg2+、Cl-、NO3- |
| D、Na+、Ba2+、NO3-、Cl- |
加入适当的氧化剂才能实现下列变化的是( )
| A、Fe2+→Fe3+ |
| B、S2-→H2S |
| C、MnO4-→Mn2+ |
| D、AlO2-→Al3+ |
下列叙述错误的是( )
| A、酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 |
| B、只含有一种元素的物质不一定都是纯净物 |
| C、电离产生H+的化合物叫酸,其分子中氢原子的个数即是该酸的元数 |
| D、压强恒定时,气体在水中的溶解度随温度的升高而降低 |
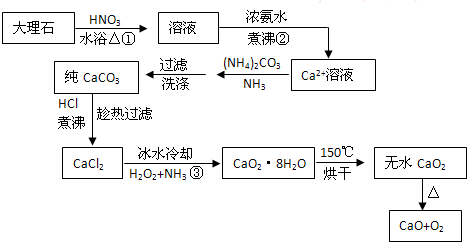
 根据图中信息,请写出:
根据图中信息,请写出: