题目内容
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素.
(1)元素T在周期表中位于第 族.
(2)J和氢组成的化合物A常用做植物生长调节剂,其电子式为 .
(3)M和R形成的一种化合物能使酸性高锰酸钾溶液褪色,该反应的离子方程式为 .
(4)写出三种仅由上述五种元素中的一种或两种元素形成的漂白剂的化学式: .
(5)其中J、L、M形成的氢化物沸点由高到低的顺序是 (用化学式表示)
| J | ||||
| R |
(2)J和氢组成的化合物A常用做植物生长调节剂,其电子式为
(3)M和R形成的一种化合物能使酸性高锰酸钾溶液褪色,该反应的离子方程式为
(4)写出三种仅由上述五种元素中的一种或两种元素形成的漂白剂的化学式:
(5)其中J、L、M形成的氢化物沸点由高到低的顺序是
考点:元素周期律和元素周期表的综合应用
专题:
分析:J、L、M、R、T是原子序数依次增大的短周期主族元素,由元素在周期表中的位置可知,J处于第二周期,R处于第三周期,J元素最低负化合价的绝对值与其原子最外层电子数相等,故J原子最外层电子数为4,故J为碳元素,M是地壳中含量最多的元素,则M为O元素,J、L、M原子序数依次增大,故L为氮,R为硫元素,T的原子序数最大,故T为Cl元素,据此解答各小题即可.
解答:
解:依据分析可知:J为碳、L为氮、M为氧、R为硫、T为氯,
(1)T为Cl,Cl元素在周期表中位于第三周期第ⅤⅡA族,故答案为:ⅤⅡA;
(2)碳和氢组成的常用做植物生长调节剂的化合物A为乙烯,乙烯分子中含有2个碳原子和4个氢原子,两个碳原子之间通过共用2对电子形成一个碳碳双键,碳碳键与碳氢键之间夹角120度,为平面型结构,其电子式为: ,故答案为:
,故答案为: ;
;
(3)SO2能使酸性高锰酸钾溶液褪色(有Mn2+生成),其反应的离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,
故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
(4)氯气具有漂白作用,臭氧具有强氧化性,具有漂白性,COCl2具有漂白性,故答案为:Cl2;O3;COCl2;
(5)元素的非金属性越强,其气态氢化物的稳定性越好,由于非金属性O>N>C,氢化物的稳定性为:H2O>NH3>CH4,故答案为:H2O>NH3>CH4;
(1)T为Cl,Cl元素在周期表中位于第三周期第ⅤⅡA族,故答案为:ⅤⅡA;
(2)碳和氢组成的常用做植物生长调节剂的化合物A为乙烯,乙烯分子中含有2个碳原子和4个氢原子,两个碳原子之间通过共用2对电子形成一个碳碳双键,碳碳键与碳氢键之间夹角120度,为平面型结构,其电子式为:
 ,故答案为:
,故答案为: ;
;(3)SO2能使酸性高锰酸钾溶液褪色(有Mn2+生成),其反应的离子方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,
故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
(4)氯气具有漂白作用,臭氧具有强氧化性,具有漂白性,COCl2具有漂白性,故答案为:Cl2;O3;COCl2;
(5)元素的非金属性越强,其气态氢化物的稳定性越好,由于非金属性O>N>C,氢化物的稳定性为:H2O>NH3>CH4,故答案为:H2O>NH3>CH4;
点评:本题主要考查的是元素的推断,以此为载体,考查学生对元素化合物知识的掌握,属于常考题.

练习册系列答案
相关题目
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛(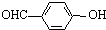 )和邻羟基苯甲醛( )和邻羟基苯甲醛(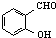 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
近年来,食品安全领域相继发生“面粉增白剂”、“彩色馒头”、“毒豆芽”、“牛肉膏”、“硫黄姜”、“地沟油”等事件,温家宝总理痛斥不法分子“道德素质严重滑坡”.下列有关说法错误的是( )
| A、对于能够改善食品的色、香、味,并有防腐、保鲜作用的食品添加剂,不必限量使用 |
| B、“面粉增白剂”中的CaO2具有强氧化性 |
| C、制作“毒豆芽”所用的亚硝酸钠(NaNO2)和使猪肉变“牛肉”时掺入的硼砂(Na2B4O7?10H2O)都属于钠盐 |
| D、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
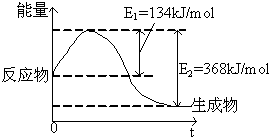 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
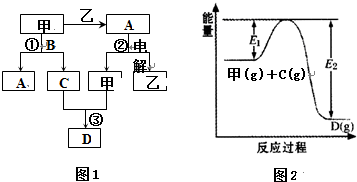
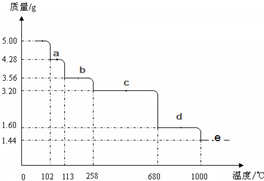
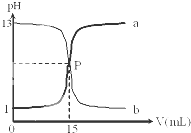 如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空: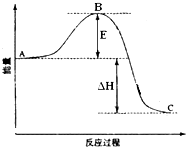 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题: