题目内容
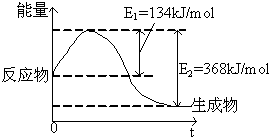 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.已知:①N2(g)+O2(g)═2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)═2NO2(g)△H=-112.3kJ/mol
请写出NO与CO反应生成无污染气体的热化学方程式:
考点:用盖斯定律进行有关反应热的计算
专题:
分析:依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答:
解:已知①N2(g)+O2(g)=2NO(g)△H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO的热化学方程式为③2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-(368-134)KJ/mol=-232KJ/mol,
由盖斯定律(②-①+③)÷2得到反应的热化学方程式:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol,
故答案为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol.
②2NO(g)+O2(g)=2NO2(g)△H=-112.3kJ/mol
298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO的热化学方程式为③2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-(368-134)KJ/mol=-232KJ/mol,
由盖斯定律(②-①+③)÷2得到反应的热化学方程式:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol,
故答案为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-759.8KJ/mol.
点评:本题考查了盖斯定律的应用,据已知反应构建所求反应方程式是解题的关键.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
X、Y、Z为三种气体,把amolX和bmolY充入一密闭容器中,发生反应X+2Y?2Z.达到平衡时,若他们的物质的量满足:n(X)+n(Y)=n(Z)则Y的转化率为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列各图所示的装置中,肯定不符合防倒吸要求的是( )
A、 |
B、 |
C、 |
D、 |
pH=1的两种酸溶液X和Y分别与足量的锌反应,酸X比酸Y产生的氢气多,下列结论正确的是( )
| A、X是强酸,Y是弱酸 |
| B、X是弱酸,Y是强酸 |
| C、X是二元酸,Y是一元酸 |
| D、无法判断X、Y的上述性质 |

 四种短周期元素A、B、C、D的性质或结构信息如下.
四种短周期元素A、B、C、D的性质或结构信息如下.