题目内容
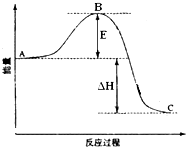 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:(1)图中A、C分别表示
(2)图中△H=
(3)已知单质硫的燃烧热为296KJ?mol-1,计算由S(s)生成3molSO3(g)的△H(要求计算过程).
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)反应物总能量大于生成物总能量,为放热反应,加入催化剂,活化能减小,反应反应热不变;
(2)根据反应2SO2(g)+O2(g)=2SO3(g)结合1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1计算反应热;
(3)依据燃烧热的概念和热化学方程式,结合盖斯定律计算得到.
(2)根据反应2SO2(g)+O2(g)=2SO3(g)结合1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1计算反应热;
(3)依据燃烧热的概念和热化学方程式,结合盖斯定律计算得到.
解答:
解:(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应反应热不变;该反应通常用V2O5作催化剂,催化剂改变反应速率,降低反应的活化能,改变反应历程,但不改变化学平衡,所以加V2O5会使图中B点降低;
故答案为:反应物能量;生成物能量;无;降低;不变;因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198;
(3)单质硫的燃烧热为296kJ?mol-1,热化学方程式为:①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.热化学方程式为②SO2(g)+
O2(g)?SO3(g)△H2=-99 KJ?mol-1 ;依据盖斯定律,②+①得到:③S(s)+
O2(g)=SO3(g)△H=(△H1+△H2)KJ/mol;计算由S(s)生成3molSO3(g)③×3得到:3 S(s)+
O2(g)=3SO3(g)△H=3(△H1+△H2)=-1185 KJ?mol-1,
故答案为:3 S(s)+
O2(g)=3SO3(g)△H=3(△H1+△H2)=-1185 KJ?mol-1.
故答案为:反应物能量;生成物能量;无;降低;不变;因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198;
(3)单质硫的燃烧热为296kJ?mol-1,热化学方程式为:①S(s)+O2(g)=SO2(g)△H1=-296 KJ?mol-1,已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.热化学方程式为②SO2(g)+
| 1 |
| 2 |
| 3 |
| 2 |
| 9 |
| 2 |
故答案为:3 S(s)+
| 9 |
| 2 |
点评:本题考查了物质反应过程中的能量变化分析判断,催化剂的作用原因,化学反应速率的计算应用,热化学方程式的书写,盖斯定律的计算应用,题目难度中等.

练习册系列答案
相关题目
pH=1的两种酸溶液X和Y分别与足量的锌反应,酸X比酸Y产生的氢气多,下列结论正确的是( )
| A、X是强酸,Y是弱酸 |
| B、X是弱酸,Y是强酸 |
| C、X是二元酸,Y是一元酸 |
| D、无法判断X、Y的上述性质 |
下列微粒对CH3COO-+H2O?CH3COOH+OH-水解平衡有影响的是( )
| A、H2O |
B、 |
| C、NO3- |
| D、Ba2+ |
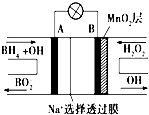 新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示 (已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )| A、放电过程中,Na+从正极区向负极区迁移 |
| B、电极B材料中含MnO2层,MnO2可增强导电性 |
| C、电池负极区的电极反应:BH4-+8OH--8e-=BO2-+6H2O |
| D、电池反应中,每消耗1 L 6 mol/L H2O2溶液,理论上流过电路中的电子为6NA个 |
对于反应KClO3+HCl=KC1+Cl2↑+H2O(未配平)若有0.1mol KClO3 参加反应,下列说法正确的是( )
| A、转移0.5 mol电子 |
| B、生成0.1 mol Cl2 |
| C、被氧化的HC1为0.6 mol |
| D、Cl2是只是氧化产物不是还原产物 |
在烧杯中加水和苯(密度:0.88g?cm-3)各50ml,将以块金属钠(密度:0.97g?cm-3)投入杯中.观察到的现象可能是( )
| A、钠在水层中反应并四处游动 |
| B、钠停在苯层中不反应 |
| C、钠在苯的液面上反应并四处游动 |
| D、钠在苯与水的界面处反应并可能上下跳动 |