题目内容
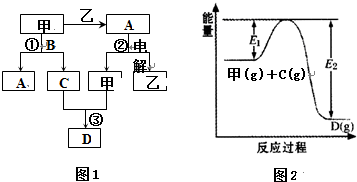
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略).
请回答下列问题:
(1)如图1所示转化过程中包含的反应类型有 (填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)如图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是 (填字母).
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(3)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为 mol?L-1?min-1.
(4)容积均为2L的四个密闭容器中均进行着(3)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如表所示:
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格:② ③
(5)已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H= .

请回答下列问题:
(1)如图1所示转化过程中包含的反应类型有
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)如图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(3)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
(4)容积均为2L的四个密闭容器中均进行着(3)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如表所示:
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
填写表中空格:②
(5)已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=
考点:无机物的推断,用盖斯定律进行有关反应热的计算,反应速率的定量表示方法,用化学平衡常数进行计算,化学平衡的影响因素
专题:
分析:(1)A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,则D为NO2,甲、乙则是两种单质,甲和乙反应生成A,电解A生成甲和乙,且C能和甲反应生成二氧化氮,则甲具有强氧化性,故甲为O2,乙是H2,A是H2O,氧气和B反应生成水和C,C和氧气反应生成二氧化氮,所以C是NO,B是NH3;
(2)反应③为:2NO+O2?2NO2 ,根据图2知,该反应是放热反应,提高一氧化氮的转化率,可以采取的措施有:降低温度、增大压强、增大氧气的量、减少二氧化氮的量等;
(3)根据2NO+O2?2NO2 可知,反应后气体物质的量减少的量等于参加反应的氧气的量,再根据v=
计算用氧气表示的化学反应速率;
(4)反应(3)中的反应为:2NO+O2?2NO2 ,I处于平衡状态,根据K=
计算平衡常数,计算II、Ⅲ中浓度熵Qc,与平衡常数比较判断反应进行方向,进而判断v正、v逆的相对大小;
(5)根据盖斯定律计算.
(2)反应③为:2NO+O2?2NO2 ,根据图2知,该反应是放热反应,提高一氧化氮的转化率,可以采取的措施有:降低温度、增大压强、增大氧气的量、减少二氧化氮的量等;
(3)根据2NO+O2?2NO2 可知,反应后气体物质的量减少的量等于参加反应的氧气的量,再根据v=
| ||
| △t |
(4)反应(3)中的反应为:2NO+O2?2NO2 ,I处于平衡状态,根据K=
| c2(NO2) |
| c2(NO)?c(O2) |
(5)根据盖斯定律计算.
解答:
解:A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,则D为NO2,甲、乙则是两种单质,甲和乙反应生成A,电解A生成甲和乙,且C能和甲反应生成二氧化氮,则甲具有强氧化性,故甲为O2,乙是H2,A是H2O,氧气和B反应生成水和C,C和氧气反应生成二氧化氮,所以C是NO,B是NH3,
(1)甲和乙发生化合反应,电解A是氧气和水属于分解反应,该反应中没有复分解反应和置换反应,故选:cd;
(2)反应③为:2NO+O2?2NO2 ,根据图2知,该反应是放热反应,则反应方程式为:2NO+O2?2NO2 △H<0,提高一氧化氮的转化率,可以采取的措施有:降低温度、增大压强、增大氧气的量、减少二氧化氮的量,而使用催化剂,加快反应速率,不影响平衡移动,加入NO,平衡向正反应方向移动,但NO的转化率降低,故选:BC;
(3)若将1 molO2和2mol NO混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,根据2NO+O2?2NO2 可知,反应后气体物质的量减少的量等于参加反应的氧气的量,故参加反应氧气为1mol+2mol-2.55mol=0.45mol,则用氧气表示的化学反应速率=
=0.075 mol/(L?min),故答案为:0.075 mol/(L?min);
(4)反应(3)中的反应为:2NO+O2?2NO2 ,I处于平衡状态,故该温度下的平衡常数K=
=
=20,
II中反应的浓度熵Qc=
=125>20,反应向逆反应进行,故v正<v逆,
Ⅲ中反应的浓度熵Qc=
=
<20,反应向正反应进行,故v正>v逆,
故答案为:20;v正<v逆;v正>v逆;
(5)已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol
反应[①+③×3]×
得C3H8(g)+5O2(g)=3CO2(g)+4H2O(l),则△H=
×[(-2741.8kJ/mol
)+(-566kJ/mol)×3]=-2219.9kJ/mol,
故答案为:-2219.9kJ/mol.
(1)甲和乙发生化合反应,电解A是氧气和水属于分解反应,该反应中没有复分解反应和置换反应,故选:cd;
(2)反应③为:2NO+O2?2NO2 ,根据图2知,该反应是放热反应,则反应方程式为:2NO+O2?2NO2 △H<0,提高一氧化氮的转化率,可以采取的措施有:降低温度、增大压强、增大氧气的量、减少二氧化氮的量,而使用催化剂,加快反应速率,不影响平衡移动,加入NO,平衡向正反应方向移动,但NO的转化率降低,故选:BC;
(3)若将1 molO2和2mol NO混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,根据2NO+O2?2NO2 可知,反应后气体物质的量减少的量等于参加反应的氧气的量,故参加反应氧气为1mol+2mol-2.55mol=0.45mol,则用氧气表示的化学反应速率=
| ||
| 3min |
(4)反应(3)中的反应为:2NO+O2?2NO2 ,I处于平衡状态,故该温度下的平衡常数K=
| c2(NO2) |
| c2(NO)?c(O2) |
(
| ||||
(
|
II中反应的浓度熵Qc=
(
| ||||
(
|
Ⅲ中反应的浓度熵Qc=
(
| ||||
(
|
| 4 |
| 27 |
故答案为:20;v正<v逆;v正>v逆;
(5)已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol
反应[①+③×3]×
| 1 |
| 2 |
| 1 |
| 2 |
)+(-566kJ/mol)×3]=-2219.9kJ/mol,
故答案为:-2219.9kJ/mol.
点评:本题考查无机物推断、化学反应速率计算、化学平衡影响因素、化学平衡常数计算、反应热计算,侧重考查学生对知识迁移运用,需要学生具备知识的基础,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
往NH4HSO4溶液中逐滴加入Ba(OH)2溶液,可能发生的离子方程式正确的是( )
| A、Ba2++SO42-=BaSO4↓ |
| B、NH4++H++2OH-=NH3?H2O+H2O |
| C、NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3?H2O+H2O |
| D、NH4++H++2SO42-+2Ba2++2OH-=2BaSO4↓+NH3?H2O+H2O |
化学无处不在,下列与化学有关的说法正确的是( )
| A、蛋白质受热能发生变性,故加热能杀死流感病毒 |
| B、食品添加剂均对人体健康有害,故应禁止使用 |
| C、维生素C因具有酸性,故可做抗氧化剂 |
| D、明矾因有净水作用,故可淡化海水 |
将足量CO2气体通入硅酸钠溶液中,然后加热蒸干,再在高温下充分反应,最后所得的固体物质是( )
| A、Na2SiO3 |
| B、Na2CO3、Na2SiO3 |
| C、Na2CO3、SiO2 |
| D、SiO2 |
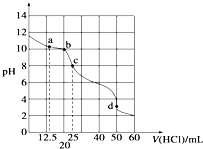 在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.100 0mol?L-1 Na2CO3溶液25mL用0.100 0mol?L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A、a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B、b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C、c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
对于反应KClO3+HCl=KC1+Cl2↑+H2O(未配平)若有0.1mol KClO3 参加反应,下列说法正确的是( )
| A、转移0.5 mol电子 |
| B、生成0.1 mol Cl2 |
| C、被氧化的HC1为0.6 mol |
| D、Cl2是只是氧化产物不是还原产物 |
 四种短周期元素A、B、C、D的性质或结构信息如下.
四种短周期元素A、B、C、D的性质或结构信息如下.