题目内容
下列各项比较中前者高于(或大于或强于)后者的是( )
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛(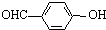 )和邻羟基苯甲醛( )和邻羟基苯甲醛(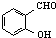 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
考点:晶体的类型与物质熔点、硬度、导电性等的关系,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.分子组成和结构相似的分子,相对分子质量越大,物质的熔沸越大;
B.根据相似相溶原理分析物质的溶解性;
C.分子内形成氢键,使熔沸点降低,分子间氢键,使熔沸点升高;
D.同等条件下亚硫酸比硫酸酸性弱;
B.根据相似相溶原理分析物质的溶解性;
C.分子内形成氢键,使熔沸点降低,分子间氢键,使熔沸点升高;
D.同等条件下亚硫酸比硫酸酸性弱;
解答:
解:A.分子组成和结构相似的分子,相对分子质量越大,物质的熔沸越大,所以SiCl4的沸点比CCl4的高,故A错误;
B.I2是非极性分子,水是极性分子,CCl4是非极性分子,根据相似相溶原理,I2在水中的溶解度小于I2在CCl4溶液中的溶解度,故B错误;
C.邻羟基苯甲醛的两个基团靠的很近,能形成分子内氢键,使熔沸点降低;而对羟基苯甲醛能够形成分子间氢键,使熔沸点升高,所以邻羟基苯甲醛比对羟基苯甲醛熔、沸点低,故C正确;
D.H2SO3是二元弱酸,H2SO4是二元强酸,同等条件下亚硫酸比硫酸酸性弱,故D错误;
故选C.
B.I2是非极性分子,水是极性分子,CCl4是非极性分子,根据相似相溶原理,I2在水中的溶解度小于I2在CCl4溶液中的溶解度,故B错误;
C.邻羟基苯甲醛的两个基团靠的很近,能形成分子内氢键,使熔沸点降低;而对羟基苯甲醛能够形成分子间氢键,使熔沸点升高,所以邻羟基苯甲醛比对羟基苯甲醛熔、沸点低,故C正确;
D.H2SO3是二元弱酸,H2SO4是二元强酸,同等条件下亚硫酸比硫酸酸性弱,故D错误;
故选C.
点评:本题考查物质熔沸点的比较、溶解度比较以及酸性比较等知识,题目难度中等.要注意相似相溶原理及氢键对熔沸点的影响.

练习册系列答案
相关题目
下列含氧酸中酸性最强的是( )
| A、H3PO4 |
| B、H3AsO4 |
| C、HNO3 |
| D、HClO |
向NaBr、NaI、Na2SO3混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到剩余固体物质的组成是( )
| A、NaCl、NaBr、Na2SO4 |
| B、NaCl、Na2SO4 |
| C、NaCl、Na2SO4、I2 |
| D、NaCl、NaI、Na2SO4 |
往NH4HSO4溶液中逐滴加入Ba(OH)2溶液,可能发生的离子方程式正确的是( )
| A、Ba2++SO42-=BaSO4↓ |
| B、NH4++H++2OH-=NH3?H2O+H2O |
| C、NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3?H2O+H2O |
| D、NH4++H++2SO42-+2Ba2++2OH-=2BaSO4↓+NH3?H2O+H2O |
 在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应达到平衡后,测得混合气体为7体积.
在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应达到平衡后,测得混合气体为7体积.