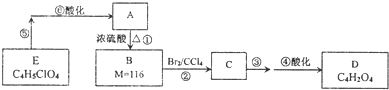
题目内容
火法炼铜可以从辉铜矿(Cu2S)中提取铜,发生如下反应:
①2Cu2S+3O2
2Cu2O+2SO2;②2Cu2O+Cu2S
6Cu+SO2↑
下面是由Cu2S冶炼铜及制取CuSO4?5H2O的流程图
Cu2S
Cu
Cu2O、CuO
A
B
胆矾
(1)Cu2S中铜元素的化合价为 ,当有1mol Cu2S与O2反应生成2mol Cu时,转移电子的物质的量是 .
(2)Cu2O,CuO中加入足量稀硫酸得到的体系A中可看到溶液呈蓝色,且有红色物质生成,且写出生成红色物质的离子方程式 .
(3)若使A单质溶解,操作Ⅰ中加入的试剂最好是 .
A、适量NaNO3 B、适量HNO3 C、适量H2O2
(4)若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH由2变为1(体积变化忽略不计),此时电解过程转移电子的物质的量是 .
(5)取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如图所示:
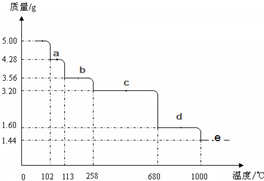
①由图中可以看出,胆矾分解的最低温度是 .
②通过计算确定258℃时发生反应的化学方程式 ,e点的化学式 (计算过程略去)
①2Cu2S+3O2
| ||
| ||
下面是由Cu2S冶炼铜及制取CuSO4?5H2O的流程图
Cu2S
| O2 |
| △ |
| 焙烧 |
| 足量稀硫酸 |
| 操作Ⅰ |
| 蒸发结晶过滤 |
(1)Cu2S中铜元素的化合价为
(2)Cu2O,CuO中加入足量稀硫酸得到的体系A中可看到溶液呈蓝色,且有红色物质生成,且写出生成红色物质的离子方程式
(3)若使A单质溶解,操作Ⅰ中加入的试剂最好是
A、适量NaNO3 B、适量HNO3 C、适量H2O2
(4)若B溶液的体积为0.2L,电解B溶液一段时间后溶液的pH由2变为1(体积变化忽略不计),此时电解过程转移电子的物质的量是
(5)取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如图所示:

①由图中可以看出,胆矾分解的最低温度是
②通过计算确定258℃时发生反应的化学方程式
考点:铜金属及其重要化合物的主要性质,化学方程式的有关计算,氧化还原反应
专题:
分析:Cu2S与氧气加热生成Cu,焙烧生成Cu2O、CuO,加入足量稀硫酸,生成硫酸铜和Cu,再加双氧水,使Cu转化为硫酸铜,蒸发结晶过滤得到胆矾;
(1)化合物中各元素化合价的代数和为0;根据硫化亚铜和铜之间的关系式计算;
(2)氧化亚铜和稀硫酸反应生成硫酸铜和铜,氧化铜和稀硫酸反应生成硫酸铜;
(3)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质;
(4)根据pH变化求出氢离子的物质的量变化,根据电解方程式计算转移的电子数;
(5)①固体质量减少时,胆矾开始分解;
②根据减少的质量确定b、c段固体的化学式,从而确定发生的反应;
根据最终剩余固体的质量采用假设的方法确定物质的组成.
(1)化合物中各元素化合价的代数和为0;根据硫化亚铜和铜之间的关系式计算;
(2)氧化亚铜和稀硫酸反应生成硫酸铜和铜,氧化铜和稀硫酸反应生成硫酸铜;
(3)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质;
(4)根据pH变化求出氢离子的物质的量变化,根据电解方程式计算转移的电子数;
(5)①固体质量减少时,胆矾开始分解;
②根据减少的质量确定b、c段固体的化学式,从而确定发生的反应;
根据最终剩余固体的质量采用假设的方法确定物质的组成.
解答:
解:(1)化合物中各元素化合价代数和为0,O元素的化合价为-2价,所以Cu元素的化合价为+1价;
①2Cu2S+3O2
2Cu2O+2SO2;②2Cu2O+Cu2S
6Cu+SO2↑,将方程式①+②得Cu2S+O2=2Cu+SO2↑,转移电子的物质的量=1mol×[4-(-2)]=6mol,
故答案为:+1;6;
(2)氧化亚铜和稀硫酸反应生成硫酸铜、铜和水,生成红色物质的离子方程式为:Cu2O+2H+=Cu+Cu 2++H2O,
故答案为:Cu2O+2H+=Cu+Cu 2++H2O;
(3)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质,硝酸具有强氧化性但引进杂质离子,氢氧化钠没有氧化性且能引进杂质离子,双氧水具有强氧化性且不引进杂质离子,故选C;
故答案为:C;
(4)若硫酸铜溶液的体积为0.2L,电解溶液一段时间后溶液的pH由2变为1,则电解生成的氢离子为0.2L×(0.1-0.01)mol/L=0.018mol,
电极方程式为:2H2O-4e-=O2↑+4H+,则n(e-)=n(H+)=0.018mol;
故答案为:0.018mol;
(5)①固体质量减少时,胆矾开始分解,根据图象知,当温度为102℃时胆矾开始分解,故答案为:102℃;
②硫酸铜的物质的量=
=0.02mol,根据胆矾的化学式知,结晶水的质量=0.02mol×5×18g/mol=1.8g,当固体质量减少1.8g时胆矾完全分解,258℃时,固体减少的质量=5.00g-3.20g=1.80g,所以C段固体是硫酸铜,b段物质减少的质量=5.00g-3.56g=1.44g,则失去的水的物质的量=
=0.08mol,则固体中剩下水的物质的量为0.02mol×5-0.08mol=0.02mol,则b段固体的化学式为CuSO4.H2O,该反应方程式为:
CuSO4.H2O
CuSO4+H2O;
e点时固体质量为1.44g,铜的质量=0.02mol×64g/mol=1.28g,则另一种元素质量为1.44g-1.28g=0.16g,如果另一种元素是S元素,则硫的物质的量为
=0.005mol,铜原子的物质的量为0.02mol,则Cu和S的个数比为4:1,不符合化合价原则,所以另一种元素是氧元素,其物质的量为
=0.01mol,所以其化学式为Cu2O,
故答案为:CuSO4.H2O
CuSO4+H2O;Cu2O.
①2Cu2S+3O2
| ||
| ||
故答案为:+1;6;
(2)氧化亚铜和稀硫酸反应生成硫酸铜、铜和水,生成红色物质的离子方程式为:Cu2O+2H+=Cu+Cu 2++H2O,
故答案为:Cu2O+2H+=Cu+Cu 2++H2O;
(3)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质,硝酸具有强氧化性但引进杂质离子,氢氧化钠没有氧化性且能引进杂质离子,双氧水具有强氧化性且不引进杂质离子,故选C;
故答案为:C;
(4)若硫酸铜溶液的体积为0.2L,电解溶液一段时间后溶液的pH由2变为1,则电解生成的氢离子为0.2L×(0.1-0.01)mol/L=0.018mol,
电极方程式为:2H2O-4e-=O2↑+4H+,则n(e-)=n(H+)=0.018mol;
故答案为:0.018mol;
(5)①固体质量减少时,胆矾开始分解,根据图象知,当温度为102℃时胆矾开始分解,故答案为:102℃;
②硫酸铜的物质的量=
| 5.00g |
| 250g/mol |
| 1.44g |
| 18g/mol |
CuSO4.H2O
| ||
e点时固体质量为1.44g,铜的质量=0.02mol×64g/mol=1.28g,则另一种元素质量为1.44g-1.28g=0.16g,如果另一种元素是S元素,则硫的物质的量为
| 0.16g |
| 32g/mol |
| 0.16g |
| 16g/mol |
故答案为:CuSO4.H2O
| ||
点评:本题考查了物质的量的有关计算、电解原理的应用、氧化还原反应等,结合元素化合价变化及氧化还原反应来分析解答,难点是(5)题,根据固体质量变化确定每一段物质的组成,从而确定每一段发生的反应,题目难度中等.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
下列各图所示的装置中,肯定不符合防倒吸要求的是( )
A、 |
B、 |
C、 |
D、 |
下列说法不正确的是( )
| A、汽油可由石油分馏和石油的催化裂化获得,可用作燃料 |
| B、利用化学方法,我们可以制造出新的分子,但不能制造出新原子 |
| C、由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子 |
| D、蔗糖及其水解产物中,只有一种物质能与新制氢氧化铜反应生成砖红色沉淀 |
将足量CO2气体通入硅酸钠溶液中,然后加热蒸干,再在高温下充分反应,最后所得的固体物质是( )
| A、Na2SiO3 |
| B、Na2CO3、Na2SiO3 |
| C、Na2CO3、SiO2 |
| D、SiO2 |
pH=1的两种酸溶液X和Y分别与足量的锌反应,酸X比酸Y产生的氢气多,下列结论正确的是( )
| A、X是强酸,Y是弱酸 |
| B、X是弱酸,Y是强酸 |
| C、X是二元酸,Y是一元酸 |
| D、无法判断X、Y的上述性质 |
在烧杯中加水和苯(密度:0.88g?cm-3)各50ml,将以块金属钠(密度:0.97g?cm-3)投入杯中.观察到的现象可能是( )
| A、钠在水层中反应并四处游动 |
| B、钠停在苯层中不反应 |
| C、钠在苯的液面上反应并四处游动 |
| D、钠在苯与水的界面处反应并可能上下跳动 |