题目内容
14.某有机物M的结构简式为CH3CH=CHCH2COOH,下列有关说法正确的是( )| A. | 能与乙醇发生酯化反应 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 能与溴的四氯化碳溶液发生取代反应 | |
| D. | 1molM与足量Na完全反应能生成1molH2 |
分析 由结构可知,分子中含碳碳双键、-COOH,结合烯烃、羧酸的性质来解答.
解答 解:A.含有羧基,可与乙醇发生酯化反应,故A正确;
B.含有碳碳双键,可被高锰酸钾氧化,故B正确;
C.含有碳碳双键,可与溴发生加成反应,在四氯化碳溶液中不发生取代反应,故C错误;
D.含有1个羧基,可与钠反应,1molM与足量Na完全反应能生成0.5molH2,故D错误.
故选AB.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃、羧酸的性质,题目难度不大.

练习册系列答案
相关题目
4.硒为第四周期VIA族元素,根据它在元素周期表中位置推测,硒不可能具有的性质是( )
| A. | 硒的氧化性比硫弱 | B. | 可以存在至少三种以上的化合价 | ||
| C. | SeO3对应水化物的酸性比HBrO4弱 | D. | 硒化氢的分子式为SeH3 |
5.如图,将锌片和铜片用导线连接后放入稀硫酸中,下列有关说法中正确的是( )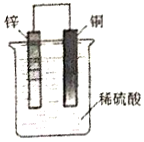

| A. | 铜片为电池的负极 | |
| B. | SO42-向负极移动 | |
| C. | 电子从铜片流向锌片 | |
| D. | 铜片上发生的电极反应为Cu-2e-═Cu2+ |
2.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知反应Fe2O3+3Na2O2$\frac{\underline{\;熔融\;}}{\;}$2Na2FeO4+Na2O,下列说法不正确的是( )
| A. | 该反应中Na2O2既是氧化剂又是还原剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 1mol Na2O2发生反应,有2mol电子转移 | |
| D. | 在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌 |
9.下列关于原子结构与元素性质的说法正确的是( )
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 全部由非金属元素组成的化合物中只含共价键 | |
| C. | ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 |
19.鉴别CII3OCH3和CH3CH2OH可采用化学方法和物理方法,下列方法不能对二者进行鉴别的是( )
| A. | 利用金属钠或金属钾 | B. | 利用质谱法 | ||
| C. | 利用红外光谱 | D. | 利用核磁共振氢谱 |
6. 短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
 短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )
短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族.m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为黄色固体,易溶在XZ2中,p是一种二元弱酸.上述物质的转化关系如图所示(反应条件省略).下列说法正确的是( )| A. | 原子半径:W<X<Y | |
| B. | W与X组成的化合物中可能含有极性键和非极性键 | |
| C. | Y与Z组成的化合物一定有漂白性 | |
| D. | W与X、Y、Z组成的简单化合物的稳定性:X>Y>Z |
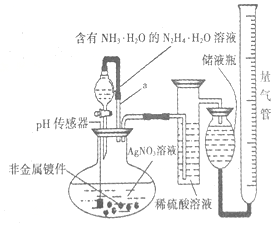 化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):
化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略): .已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.
.已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.