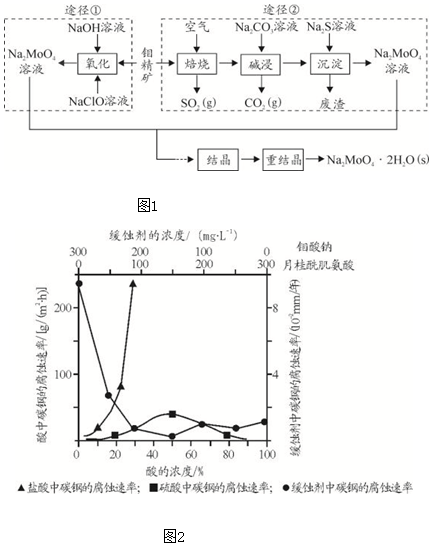
题目内容
9.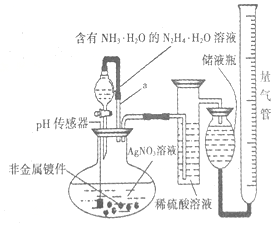 化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):
化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):化学镀银中的反应如下:
Ⅰ:4AgNO3+N2H4•H2O=4Ag↓+N2↑+4HNO3+H2O
Ⅱ:NH3•H2O+HNO3=NH4NO3+H2O
Ⅲ:Ag++2NH3•H2O?[Ag(NH3)2]++2H2O
(1)写出N2H4的电子式
 .已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.
.已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.(2)带有导管a的分液漏斗叫恒压漏斗,下列关于恒压漏斗在该实验中的作用说法正确的是BC(填选项字母)
A.防止稀硫酸倒吸进人圆底烧瓶
B.使漏斗中液体顺利流下
C.减小液体体积对测量气体体积的误差
D.方便检验装置的气密性
(3)银膜是否均匀致密的关键在于“沉银”速率控制,一般速率越慢,银膜越均匀越致密.简述加入氨水的另外一个目的与Ag+反应降低任由中Ag+浓度,以达到降低反应速率的目的.
(4)未被还原的Ag+占总银元素质量比(ω1)叫非还原损耗,被还原但是没有在镀件上附着沉淀的银占总银元素质量比(ω2)叫还原损耗.实验中用200mL 0.l00ml/L AgNO3溶液,加过量的N2H4•H2O,测得相关数据如下:
Ⅰ:非金属镀件镀前质量为20.000克,镀后质量(已清洗干燥)为21.728 克;
Ⅱ:量气管收集到的气体折算标准状况体积为106.400mL.
则ω1=5%;ω2=15%.
(5)化学镀银中常用次磷酸钠(NaH2PO2)做还原剂,已知该反应的氧化产物为磷酸,写出该反应的离子反应方程式:H2PO2-+4Ag++2H2O=4Ag↓+3H++H3PO4.
分析 (1)N2H4是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,若呈酸性,被还原的是硝酸,得不到金属银,从而导致实验失败,因此控制溶液的pH在8-9之间;
(2)恒压漏斗液面上方气体压强与烧瓶中气体的压强相同,可以使漏斗中液体顺利流下,也能减小因加入液体体积对测定气体体积造成误差;
(3)在N2H4•H2O中加入适量氨水,可以与Ag+反应,降低任由中Ag+浓度,以达到降低反应速率的目的,使银膜更加均匀致密;
(4)200mL 0.l00ml/L AgNO3溶液中溶质硝酸银物质的量=0.20L×0.100mol/L=0.02mol,非金属镀件镀前镀后质量差为银的质量,m(Ag)=21.728 g-20.000g=1.728g,物质的量n(Ag)=$\frac{1.728g}{108g/mol}$=0.016mol,收集到的氮气的物质的量=$\frac{0.1064L}{22.4L/mol}$=0.00475mol,因此反应的银离子总量为0.00475mol×4=0.19mol,据此计算非还原损耗,还原损耗;
(5)化学镀银中常用次磷酸钠(NaH2PO2)做还原剂,已知该反应的氧化产物为磷酸,结合电子守恒、原子守恒和电荷守恒配平书写离子方程式.
解答 解:(1)肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,电子式为
故答案为:
(2)带有导管a的分液漏斗叫恒压漏斗,恒压漏斗液面上方气体压强与烧瓶中气体的压强相同,保持内外压强相平可以使漏斗中液体顺利流下,也能减小因加入液体体积对测定气体体积造成误差,故选BC,
故答案为:BC;
(3)银膜是否均匀致密的关键在于“沉银”速率控制,一般速率越慢,银膜越均匀越致密,在N2H4•H2O中加入适量氨水,可以与Ag+反应,降低任由中Ag+浓度,以达到降低反应速率的目的,使银膜更加均匀致密,加入氨水的另外一个目的是:与Ag+反应降低任由中Ag+浓度,以达到降低反应速率的目的,
故答案为:与Ag+反应降低任由中Ag+浓度,以达到降低反应速率的目的;
(4)200mL 0.l00ml/L AgNO3溶液中溶质硝酸银物质的量=0.20L×0.100mol/L=0.02mol,非金属镀件镀前镀后质量差为银的质量,m(Ag)=21.728 g-20.000g=1.728g,物质的量n(Ag)=$\frac{1.728g}{108g/mol}$=0.016mol,收集到的氮气的物质的量=$\frac{0.1064L}{22.4L/mol}$=0.00475mol,因此反应的银离子总量为0.00475mol×4=0.19mol,则ω1=$\frac{0.2mol-0.19mol}{0.2mol}$×100%=5%,$\frac{0.19mol-0.16mol}{0.2mol}$×100%=15%,
故答案为:5%;15%;
(5)化学镀银中常用次磷酸钠(NaH2PO2)做还原剂,已知该反应的氧化产物为磷酸,反应的离子方程式为:H2PO2-+4Ag++2H2O=4Ag↓+3H++H3PO4,
故答案为:H2PO2-+4Ag++2H2O=4Ag↓+3H++H3PO4.
点评 本题考查了物质含量测定实验方案设计,题目难度中等,理解测定的原理是解题关键,注意(5)计算要正确理解非还原损耗和还原损耗的概念.

| A. | 能与乙醇发生酯化反应 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 能与溴的四氯化碳溶液发生取代反应 | |
| D. | 1molM与足量Na完全反应能生成1molH2 |
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为0.045mol/L(精确到千分位).
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为CuO和Fe2O3质量为1.6g.
| A. | 重结晶纯化法 | B. | 萃取纯化法 | C. | 吸附纯化法 | D. | 蒸馏纯化法 |
| A. | HCO3-+H2O?CO32-+H3O+ | B. | HCO3-+OH-?CO32-+H2O | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | S2-+2H2O?H2S+2OH- |
| A. | 都能作干燥剂 | B. | 都具有一定的氧化性 | ||
| C. | 加热时都能与铜发生反应 | D. | 在常温下都能用铁制容器贮存 |
| A. | H+、Cl-、PO43-、Na+ | B. | H+、Fe2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | K+、H+、NO${\;}_{3}^{-}$、Na+ | D. | OH-、Br-、SO42-、NH4+ |
 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.