题目内容
5.如图,将锌片和铜片用导线连接后放入稀硫酸中,下列有关说法中正确的是( )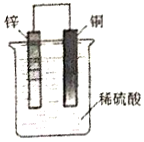
| A. | 铜片为电池的负极 | |
| B. | SO42-向负极移动 | |
| C. | 电子从铜片流向锌片 | |
| D. | 铜片上发生的电极反应为Cu-2e-═Cu2+ |
分析 Zn、Cu与硫酸形成的原电池中,较活泼的金属锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应生成氢气;电子从负极沿导线流向正极;溶液中阴离子向负极移动,阳离子向正极移动,据此解答.
解答 解:A.较活泼的金属锌作负极,铜作正极,故A错误;
B.原电池工作时,溶液中阴离子向负极移动,即SO42-移向负极,故B正确;
C.原电池工作时,电子从负极锌沿导线流向正极铜,故C错误;
D.铜片作正极,正极上氢离子得电子生成氢气,电极反应为2H++2e-=H2↑,故D错误;
故选B.
点评 本题考查了原电池的工作原理,为高频考点,把握原电池的工作原理为解答的关键,侧重电极、电极反应的考查,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
15.下列说法正确的是( )
①聚乙烯塑料的老化是因为发生了加成反应
②利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
③淀粉、油脂、蛋白质在一定条件下都能发生水解反应
④石油的分馏和煤的干馏都是发生了化学变化
⑤单糖、二糖都能与新制Cu(OH)2发生反应
⑥向蛋白质溶液中滴加饱和NaCl溶液或CuSO4溶液,均有固体析出.
①聚乙烯塑料的老化是因为发生了加成反应
②利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
③淀粉、油脂、蛋白质在一定条件下都能发生水解反应
④石油的分馏和煤的干馏都是发生了化学变化
⑤单糖、二糖都能与新制Cu(OH)2发生反应
⑥向蛋白质溶液中滴加饱和NaCl溶液或CuSO4溶液,均有固体析出.
| A. | ①②③④⑤ | B. | ②③⑥ | C. | ②③④⑤ | D. | ②⑤⑥ |
16.四联苯  的一氯代物有( )
的一氯代物有( )
 的一氯代物有( )
的一氯代物有( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
13.与CO互为等电子体的是( )
| A. | CO2 | B. | N2 | C. | HCl | D. | O2 |
20.目前,我市电能的主要来源是火力发电. 下列关于火力发电过程中能量转化关系的描述,正确的是( )

| A. | 化学能转化成机械能在转化成电能 | |
| B. | 化学能转化成热能在转化成电能 | |
| C. | 化学能转化成机械能在转化成热能在到机械能 | |
| D. | 化学能转化成热能在转化成机械能在到电能 |
10.下列有关离子键与共价键的说法中,正确的是( )
| A. | 共价化合物中一定没有离子键 | |
| B. | 单质中一定没有离子键,一定有共价键 | |
| C. | 共价键通过原子之间得失电子形成 | |
| D. | 非金属元素组成的化合物中不可能有离子键 |
17.一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
| A. | 若增大压强,则物质Y的转化率减小 | |
| B. | 将容器体积变为5 L,Z的平衡浓度变为原来的2倍 | |
| C. | Y浓度变化表示的反应速率为0.0005 mol/(L•s ) | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
14.某有机物M的结构简式为CH3CH=CHCH2COOH,下列有关说法正确的是( )
| A. | 能与乙醇发生酯化反应 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 能与溴的四氯化碳溶液发生取代反应 | |
| D. | 1molM与足量Na完全反应能生成1molH2 |
20.某工业废水中仅含表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
甲同学欲探究废水的组成,进行了如下实验:
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为0.045mol/L(精确到千分位).
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为CuO和Fe2O3质量为1.6g.
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
I.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为0.045mol/L(精确到千分位).
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体为CuO和Fe2O3质量为1.6g.