题目内容
15.200mL Fe2(SO4)3溶液中含Fe3+5.6g,溶液中SO42-的物质的量浓度是( )| A. | 0.5mol/L | B. | 0.75 mol/L | C. | 1 mol/L | D. | 0.25 mol/L |
分析 n(Fe3+)=$\frac{5.6g}{56g/mol}$=0.1mol,由Fe2(SO4)3可知,n(SO42-)=0.1mol×$\frac{3}{2}$=0.15mol,结合c=$\frac{n}{V}$计算.
解答 解:n(Fe3+)=$\frac{5.6g}{56g/mol}$=0.1mol,由Fe2(SO4)3可知,n(SO42-)=0.1mol×$\frac{3}{2}$=0.15mol,则溶液中SO42-的物质的量浓度是$\frac{0.15mol}{0.2L}$=0.75 mol/L,
故选B.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的量浓度、物质的量的关系及物质构成为解答的关键,侧重分析与计算能力的考查,注意硫酸根离子物质的量计算,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
5.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知H2(g)+Cl2(g)═2HCl(g)△H=-185kJ/mol,则氢气的燃烧热为185 kJ/mol | |
| B. | 已知石墨比金刚石稳定,则C (石墨,s)═C(金刚石,s)△H<0 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
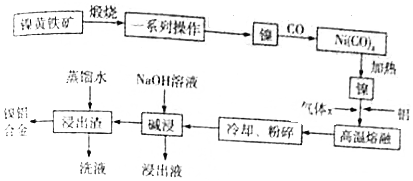
| D. | 已知Ni(CO)4(s)═Ni(s)+4CO(g)△H=+Q kJ•mol-1,则Ni(s)+4CO(g)═Ni(CO)4(s)△H=-Q kJ•mol-1 |
6.通过以下反应均可获取H2.下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ•mol-1.
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=+571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ•mol-1.
| A. | 反应CH4(g)═C(s)+2 H2(g)的△H4=+74.8kJ•mol-1 | |
| B. | 反应①中电能转化为化学能 | |
| C. | 反应②中反应物的总能量高于生成物的总能量 | |
| D. | 反应③使用催化剂,△H3减小 |
10.某烃分子中含一个苯环结构和两个三键,则该烃的化学式不可能是( )
| A. | C10H6 | B. | C13H12 | C. | C15H16 | D. | C19H22 |
20.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1L 0.1mol•L-1的NaHCO3-溶液中HCO3-离子数为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| D. | 235g核互${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为1 |
4.乙稀利(C2H6ClO3P)植物生长调节剂,它可由环氧乙烧和PCl3为原料合成.相关表示不正确的是( )
| A. | 环氧乙烷的结构简式:C2H4O | B. | 中子数为16的磷原子:${\;}_{15}^{16}$P | ||
| C. | 氯原子的结构示意图: | D. | PC13的电子式: |