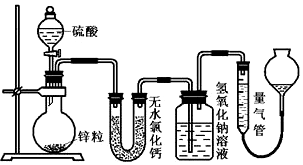
题目内容
5.一种带有多孔结构的镍铝合金对H2具有较强的吸附性,其高催化活性和热稳定性使得该镍铝合金被用于很多工业过程中和有机合成反应中.如图是以镍黄铁矿(主要成分为NiS、FeS等)为原料制备该镍铝合金的工艺流程图: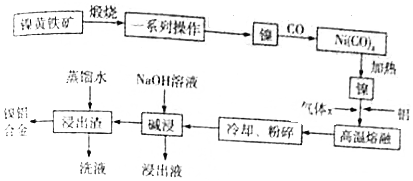
回答下列问题:
(1)Ni(CO)4中C、O化合价与CO中的C、O化合价相同,则Ni化合价为0价.
(2)在空气中“煅烧”生成Ni2O3和Fe2O3,写出Fe2O3的化学方程式4FeS+7O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2.
(3)操作“镍$\stackrel{CO}{→}$Ni(CO)4$\stackrel{加热}{→}$镍”的目的是提纯镍.
(4)Ni、Al高温熔融时,气体x的作用是保护Ni、Al,防止其被氧化.对“高温熔融”物冷却后,需要进行粉碎处理,粉碎处理的目的是增大接触面积,提高“碱浸“的反应速率.
(5)“碱浸”可以使镍产生多孔结构,从而增强对H2的吸附性,“浸出液”中的主要离子是Na+、AlO2-或[Al(OH)4]-、OH-;“浸出液”中的铝元素可循环利用,写出回收“浸出液”中的铝元素,并制备“高温熔融”时的原料Al的流程:浸出液$\stackrel{足量CO_{2}}{→}$Al(OH)3$\stackrel{灼烧}{→}$Al2O3(熔融)$→_{冰晶石}^{电解}$Al(示例:CuO$\stackrel{H+}{→}$Cu2+$\stackrel{Fe}{→}$Cu).
分析 红土镍矿(主要成分为NiS、FeS等)煅烧发生氧化还原反应得到Ni2O3、Fe2O3,经过对铁元素除杂得到镍,再通入CO气体,形成Ni(CO)4,加热得到镍,加入铝,高温熔融时通入惰性气体保护Ni、Al,得到合金,将合金“高温熔融”后冷却、粉碎,再用浓氢氧化钠溶液碱浸,铝与氢氧化钠反应产生氢气使镍铝合金产生多孔的结构,浸出液中含偏铝酸根,最后用蒸馏水洗浸出渣,得到产品镍铝合金,据此分析解答.
解答 解:(1)Ni(CO)4中C、O化合价与CO中的C、O化合价相同,化合物化合价代数和为0,则Ni化合价为0;
故答案为:0;
(2)在空气中“煅烧”生成Ni2O3和Fe2O3,发生氧化还原反应得到Ni2O3、Fe2O3,其中生成Fe2O3的化学方程式为4FeS+7O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+4SO2;
故答案为:4FeS+7O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+4SO2;
(3)操作“镍$\stackrel{CO}{→}$Ni(CO)4$\stackrel{加热}{→}$镍”的目的是提纯镍;
故答案为:提纯镍;
(4)高温熔融时通入惰性气体保护Ni、Al,防止其被氧化,得到合金;将合金“高温熔融”后冷却、粉碎,再用浓氢氧化钠溶液碱浸,粉碎处理目的是增大接触面积,提高“碱浸“的反应速率;
故答案为:保护Ni、Al,防止其被氧化;增大接触面积,提高“碱浸“的反应速率;
(5)将合金冷却、粉碎,再用浓氢氧化钠溶液碱浸,铝与氢氧化钠反应产生氢气使镍铝合金产生多孔的结构,发生的反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,浸出液中含偏铝酸钠;
故答案为:Na+、AlO2-或[Al(OH)4]-、OH-;
(6)浸出液B中含偏铝酸钠,可通入过量二氧化碳得到氢氧化铝沉淀,再加热灼烧使其分解得到氧化铝,加入冰晶石,在熔融态下电解氧化铝得到铝,回收流程可表示为:浸出液$\stackrel{足量CO_{2}}{→}$Al(OH)3$\stackrel{灼烧}{→}$Al2O3(熔融)$→_{冰晶石}^{电解}$Al;
故答案为:浸出液$\stackrel{足量CO_{2}}{→}$Al(OH)3$\stackrel{灼烧}{→}$Al2O3(熔融)$→_{冰晶石}^{电解}$Al.
点评 本题考查了物质的制备,重点考查学生对工艺流程试题了解掌握情况,试题综合性强,贴近高考,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | 0.5mol/L | B. | 0.75 mol/L | C. | 1 mol/L | D. | 0.25 mol/L |
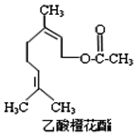 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( ) ①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
| A. | ①②③ | B. | ①②⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
| A. | a与氢元素能形成原子个数之比为1:1的化合物 | |
| B. | b单质能与水、无水乙醇反应 | |
| C. | c3+与d-的最外层电子数和电子层数都不相同 | |
| D. | a与d可形成含有极性共价键的化合物 |
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.试回答下列问题:
(1)分别写出B、D的化学式.B、Ba(OH)2DAgNO3;
(2)写出A、E反应的离子方程式:2Al3++3CO32-+3H2O═3CO2↑+2Al(OH)3↓;
(3)A溶液中各种离子浓度由大到小的顺序为[Na+]>[CO32-]>[OH-]>[HCO3-]>[H+]
(4)已知:NaOH( aq)+HNO3(aq)=NaNO3( aq)+H20(1)△H=-Q kJ•mol-l.写出B与C稀溶液反应的热化学方程式OH-(aq)+H+(aq)=H2O(1)△H=-QkJ/mol或$\frac{1}{2}$Ba(OH)2(aq)+HC1(aq)=$\frac{1}{2}$BaC12(aq)+H2O(1)△H=-QkJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2QkJ/mol
(5)在100 mL0.1 mol•L-1 E溶液中,逐滴加入40 mL1.6 mol•L-1NaOH溶液,最终得到沉淀物质的量为0.016mol.
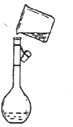 实验室需要配制100mL 0.1mol•L-1 CuSO4溶液.
实验室需要配制100mL 0.1mol•L-1 CuSO4溶液. 某品牌果冻标签如图所示.回答下列问题:
某品牌果冻标签如图所示.回答下列问题: