题目内容
7.写出下列反应的化学方程式(1)氯乙烷与NaOH溶液混合CH3CH2Cl+NaOH$\stackrel{△}{→}$NaCl+CH3CH2OH
(2)苯的硝化反应

(3)1,2-二溴丙烷与NaOH醇溶液混合加热CBrH2CHBrCH3+2NaOH$\stackrel{醇}{→}$CH≡CHCH3↑+2H2O+2NaBr.
分析 (1)氯乙烷与NaOH溶液混合,氯乙烷发生水解生成氯化钠和乙醇;
(2)苯与浓硝酸在浓硫酸催化作用下生成硝基苯和水;
(3)1,2-二溴丙烷与NaOH醇溶液混合加热,发生消去反应生成丙炔和溴化钠.
解答 解:(1)氯乙烷和氢氧化钠溶液加热发生取代反应生成乙醇和氯化钠,反应的化学方程式为:CH3CH2Cl+NaOH$\stackrel{△}{→}$NaCl+CH3CH2OH;
故答案为:CH3CH2Cl+NaOH$\stackrel{△}{→}$NaCl+CH3CH2OH;
(2)苯和浓硝酸在浓硫酸作催化剂、50℃~60℃加热条件下发生取代反应生成硝基苯,反应方程式为 ,
,
故答案为: .
.
(3)1,2-二溴丙烷与NaOH醇溶液混合加热,发生消去反应生成丙炔和溴化钠,方程式:CBrH2CHBrCH3+2NaOH$\stackrel{醇}{→}$CH≡CHCH3↑+2H2O+2NaBr;
故答案为:CBrH2CHBrCH3+2NaOH$\stackrel{醇}{→}$CH≡CHCH3↑+2H2O+2NaBr;
点评 本题考查了有机化学方程式的书写,题目难度不大,明确反应的实质是解题的关键,注意有机反应,副反应多,书写时用→表示.

练习册系列答案
相关题目
17.胶体区别于其他分散系的根本原因是( )
| A. | 胶体粒子带电 | B. | 胶体粒子不可穿过半透膜 | ||
| C. | 分散质粒子直径在1~100 nm之间 | D. | 胶体有丁达尔现象 |
15.200mL Fe2(SO4)3溶液中含Fe3+5.6g,溶液中SO42-的物质的量浓度是( )
| A. | 0.5mol/L | B. | 0.75 mol/L | C. | 1 mol/L | D. | 0.25 mol/L |
2.下列说法不正确的是( )
| A. | 在化学反应中,伴随着物质的变化,既有化学键的断裂又有化学键的形成,还有化学能的改变 | |
| B. | 在化学反应过程中是放出热量还是吸收热量,取决于反应物总能量与生成物总能量的相对大小 | |
| C. | 需要加热的化学反应,该化学反应过程一定是吸收能量 | |
| D. | 物质具有的能量越低,其稳定性越大,反应越难以发生;物质具有的能量越高,其稳定性越小,反应越容易发生 |
12.在某200mL的混合溶液中,硝酸和硫酸的物质的量浓度分别为0.4mol/L、0.1mol/L,向溶液中加入3.84g铜粉,加热,待充分反应后,收集到标况下气体体积为( )
| A. | 1792mL | B. | 896mL | C. | 672mL | D. | 448mL |
19.某无色透明溶液中存在大量的H+、Cl-、NO3-,该溶液中还可能大量存在的是( )
| A. | HCO3- | B. | Cu2+ | C. | NH4+ | D. | Ag+ |
16.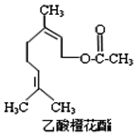 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( ) ①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
| A. | ①②③ | B. | ①②⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
17.原子序数依次增大的短周期主族元素a、b、c、d,它们的最外层电子数分别为4、1、x、7,c原子的电子层数等于x,d-的电子层结构与氩相同.下列说法错误的是( )
| A. | a与氢元素能形成原子个数之比为1:1的化合物 | |
| B. | b单质能与水、无水乙醇反应 | |
| C. | c3+与d-的最外层电子数和电子层数都不相同 | |
| D. | a与d可形成含有极性共价键的化合物 |