题目内容
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境.采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率.相关反应的热化学方程式如下:CaSO4(s)+CO(g)═CaO(s)+SO2(g)+CO2(g)△H1=+218.4kJ?mol-1(反应Ⅰ)CaSO4(s)+4CO(g)═CaS(s)+4CO2(g)△H2=-175.6kJ?mol-1(反应Ⅱ)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的( )
A、 |
B、 |
C、 |
D、 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:反应Ⅰ为吸热反应,反应Ⅱ为放热反应,结合反应物与生成物总能量大小之间的关系判断.
解答:
解:反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误;反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较大,则B错误、C正确,
故选C.
故选C.
点评:本题为2014浙江高考题的一部分,涉及化学平衡以及反应热与焓变的考查,题目难度中等.

练习册系列答案
相关题目
 对可逆反应:A(g)+2B(s)?C(s)+D(g);△H>0(正反应为吸热反应).如图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件是( )
对可逆反应:A(g)+2B(s)?C(s)+D(g);△H>0(正反应为吸热反应).如图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件是( )| A、②③ | B、①② | C、③④ | D、④⑤ |
 有一反应,由X与Y化合生成Z.其反应如右:2X+3Y=2Z,反应物X与生成物Z的质量关系如图.下列说法正确的是( )
有一反应,由X与Y化合生成Z.其反应如右:2X+3Y=2Z,反应物X与生成物Z的质量关系如图.下列说法正确的是( )| A、有4g的Z生成时,则消耗Y 6g |
| B、X、Y、Z的摩尔质量之比为3:2:6 |
| C、2mol X质量与3mol Y质量之和等于2mol Z的质量 |
| D、消耗2mol X时,在标准状况下,生成Z的体积为44.8L |
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸 |
| C、加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝 |
| D、高温下,用金属钠与氯化钾可以置换出金属钾,说明钠的金属性比钾强 |
常温下将甲酸与NaOH溶液混合,所得溶液的PH=7则此溶液中( )
| A、C(HCOO-)>C(Na+) |
| B、C(HCOO-)<C(Na+) |
| C、(HCOO-)=C(Na+) |
| D、无法确定关系 |


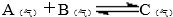 )前起始体积相同、且容积固定的容器中发生上述反应开始时放入1mol A和1mol B到达平衡后生成bmol C.将b与(1)小题中的a进行比较
)前起始体积相同、且容积固定的容器中发生上述反应开始时放入1mol A和1mol B到达平衡后生成bmol C.将b与(1)小题中的a进行比较 (1)已知:H2(g)+O2(g)═H2O(g),反应过程中能量变化如图所示,则:
(1)已知:H2(g)+O2(g)═H2O(g),反应过程中能量变化如图所示,则: 反应方程式.
反应方程式.