题目内容
可逆反应2A(g)+B(g)
2C(g),根据下表中的数据判断下列图象错误的是( )
| 催化剂 |
| △ |
 | p1(Mpa) | p2(Mpa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |
A、 |
B、 |
C、 |
D、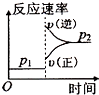 |
考点:化学反应速率与化学平衡图象的综合应用
专题:
分析:由表中数据可知,在相同压强下,升高温度,A的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,在相同温度下,增大压强,A的转化率增大,说明平衡向正反应方向移动,对比图象可解答该题.
解答:
解:由表中数据可知,在相同压强下,升高温度,A的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,在相同温度下,增大压强,A的转化率增大,说明平衡向正反应方向移动,则
A.升高温度,A的转化率降低,与表中数据吻合,故A正确;
B.升高温度,平衡向逆反应方向移动,C的百分含量降低,增大压强,平衡向正反应方向移动,C的百分含量增大,与表中数据吻合,故B正确;
C.升高,反应速率增大,平衡向逆反应方向移动,逆反应速率大于正反应速率,与表中数据吻合,故C正确;
D.增大压强,反应速率增大,正反应速率大于逆反应速率平衡向正反应方向移动,图象与表中数据不吻合,故D错误.
故选D.
A.升高温度,A的转化率降低,与表中数据吻合,故A正确;
B.升高温度,平衡向逆反应方向移动,C的百分含量降低,增大压强,平衡向正反应方向移动,C的百分含量增大,与表中数据吻合,故B正确;
C.升高,反应速率增大,平衡向逆反应方向移动,逆反应速率大于正反应速率,与表中数据吻合,故C正确;
D.增大压强,反应速率增大,正反应速率大于逆反应速率平衡向正反应方向移动,图象与表中数据不吻合,故D错误.
故选D.
点评:本题考查温度温度、压强对平衡移动的影响,题目难度中等,注意分析表中数据以及图象的曲线的变化,学习中注意加强该方面能力的培养.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
下列反应的离子方程式中,书写正确的是( )
| A、氢氧化钡与硫酸反应Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、铁粉跟稀盐酸反应2Fe+6H+=2Fe3++3H2↑ |
| C、氯化钙溶液跟碳酸钠溶液反应Ca2++CO32-=CaCO3↓ |
| D、碳酸钙跟盐酸反应CO32-+2H+=H2O+CO2↑ |
使1.0体积的某气态烷烃和烯烃的混合气体在足量空气中完全燃烧,生成2.0体积的二氧化碳和2.2体积的水蒸气(均在120℃、1.01×105Pa条件下测定),则混合气体中烷烃和烯烃的体积比为( )
| A、2:3 | B、1:4 |
| C、4:1 | D、3:2 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)2SO3(g)△H=-196.4kJ?mol-1实验测得起始、平衡时的有关数据如下表:下列叙述不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中 的能量变化 | ||
| SO2 | O2 | SO3 | ||
| ① | 2 | 1 | 0 | 放出热量a kJ |
| ② | 1 | 0.5 | 0 | 放出热量b kJ |
| ③ | 0 | 0 | 2 | 吸收热量c kJ |
| A、平衡时SO3气体的体积分数:③=①>② |
| B、a+c=196.4 |
| C、三个容器内反应的平衡常数:③=①=② |
| D、平衡时O2的浓度:①=③=2×② |
下列叙述不正确的是( )
| A、待检液逐滴加入NaOH溶液,有白色胶状沉淀产生后来沉淀逐渐消失,则原溶液中可能含有Al3+ |
| B、待检液中先加入KSCN溶液,无明显现象,再加入氯水溶液显血红色,则待检液中一定含有Fe2+ |
| C、将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含K+ |
| D、向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- |
30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是( )
| A、c(H+)?c(OH-)>1×10-14 |
| B、c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| C、c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |


