题目内容
使1.0体积的某气态烷烃和烯烃的混合气体在足量空气中完全燃烧,生成2.0体积的二氧化碳和2.2体积的水蒸气(均在120℃、1.01×105Pa条件下测定),则混合气体中烷烃和烯烃的体积比为( )
| A、2:3 | B、1:4 |
| C、4:1 | D、3:2 |
考点:有关混合物反应的计算
专题:
分析:相同条件下气体的物质的量之比=物质的量之比,根据题中数据计算出混合烃的平均分子式;常温下为气态烃的分子中碳原子数≤4,分别根据气体烷烃、气体烯烃的分子组成及混合气体的平均分子式得出合理的组合,最后通过讨论计算出满足条件的烷烃和烯烃的体积比.
解答:
解:同温同压下,气体的体积之比等于其物质的量之比,该温度下水为气体,设混合气态烃平均分子组成CxHy,
根据质量守恒可得:x=
=2、y=
=4.4,
则混合烃的平均分子式为:C2H4.4,

气态烃的碳原子数≤4,则满足C2H4.4合理组合有:①CH4、C3H6②CH4、C4H8③C2H6、C2H4,
①CH4、C3H6:根据平均分子式可知,甲烷与丙烯的物质的量之比为1:1,而平均H原子数为5≠4.4,所以不合理;
②CH4、C4H8:平均C原子为2时,设甲烷的物质的量为x、丁烯的物质的量为y,则
=2,解得:x:y=2:1,此时得到的混合物中平均H原子数为:
=
≠4.4,所以不合理;
③C2H6、C2H4:二者任意比混合后平均C原子数都是2,氢原子平均数为4.4时,设乙烷的物质的量为x、乙烯的物质的量为y,则:
=4.4,整理可得:x:y=1:4,满足条件,
故选B.
根据质量守恒可得:x=
| 2.0 |
| 1.0 |
| 2.2×2 |
| 1.0 |
则混合烃的平均分子式为:C2H4.4,

气态烃的碳原子数≤4,则满足C2H4.4合理组合有:①CH4、C3H6②CH4、C4H8③C2H6、C2H4,
①CH4、C3H6:根据平均分子式可知,甲烷与丙烯的物质的量之比为1:1,而平均H原子数为5≠4.4,所以不合理;
②CH4、C4H8:平均C原子为2时,设甲烷的物质的量为x、丁烯的物质的量为y,则
| x+4y |
| x+y |
| 4×2+8 |
| 2+1 |
| 16 |
| 3 |
③C2H6、C2H4:二者任意比混合后平均C原子数都是2,氢原子平均数为4.4时,设乙烷的物质的量为x、乙烯的物质的量为y,则:
| 6x+4y |
| x+y |
故选B.
点评:本题考查有关混合物反应的计算,题目难度中等,根据题干信息计算出平均分子式为解答关键,注意讨论法、平均分子式法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
对2Na2O2+2CO2═2Na2CO3+O2下列说法正确的是( )
| A、是氧化还原反应,Na2O2是氧化剂,CO2是还原剂 |
| B、是氧化还原反应,CO2是氧化剂,Na2O2是还原剂 |
| C、不是氧化还原反应,是碱性氧化和酸性氧化物反应 |
| D、是氧化还原反应,Na2O2既是氧化剂,又是还原剂 |
某同学实际配制的NaOH溶液的浓度偏低,其原因不正确的是( )
| A、使用滤纸称量NaOH固体 |
| B、容量瓶中原来存在少量蒸馏水 |
| C、溶解后的烧杯未经洗涤 |
| D、定容时仰视刻度线 |
根据陈述的知识,类推得出的结论正确的是( )
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、已知ⅣA沸点CH4<SiH4<GeH4,则ⅤA族沸点 NH3<PH3<AsH3 |
| C、已知Fe与S直接化合生成FeS,则Cu与S直接化合生成Cu2S |
| D、已知Ca(HCO3)2+2NaOH(过量)=CaCO3↓+Na2CO3+2H2O,则Mg(HCO3)2+2NaOH(过量)=MgCO3↓+Na2CO3+2H2O |
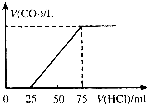 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.