题目内容
下列实验现象正确且所推出的结论也正确的是( )
| 选项 | 实验现象 | 结论 |
| A | 向溶液中滴加盐酸产生的气体能使澄清石灰水变浑浊 | 溶液中一定有CO32- |
| B | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | Ksp(BaSO4)>Ksp(BaCO3) |
| C | Na2SO3溶液可以使溴水褪色 | Na2SO3有还原性 |
| D | Cl2、SO2均能使紫色石蕊溶液褪色 | 二者均有漂白性 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.溶液中也可能存在HCO3-等离子;
B.Qc>Ksp时,生成沉淀;
C.Na2SO3有还原性;
D.二氧化硫不能使石蕊褪色.
B.Qc>Ksp时,生成沉淀;
C.Na2SO3有还原性;
D.二氧化硫不能使石蕊褪色.
解答:
解:A.溶液中也可能存在HCO3-等离子,故A错误;
B.将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化BaCO3,是Qc(BaCO3)>Ksp(BaCO3)生成沉淀,不发生沉淀的转化,Ksp(BaSO4)<Ksp(BaCO3),故B错误;
C.Na2SO3有还原性,能使溴水褪色,故C正确;
D.二氧化硫不能使石蕊褪色,遇石蕊变红,故D错误.
故选C.
B.将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化BaCO3,是Qc(BaCO3)>Ksp(BaCO3)生成沉淀,不发生沉淀的转化,Ksp(BaSO4)<Ksp(BaCO3),故B错误;
C.Na2SO3有还原性,能使溴水褪色,故C正确;
D.二氧化硫不能使石蕊褪色,遇石蕊变红,故D错误.
故选C.
点评:本题考查化学实验方案的评价,为高频考点,涉及离子检验、沉淀转化、氧化还原反应以及指示剂等,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,题目难度不大.

练习册系列答案
相关题目
工业上冶炼锡的第一步反应原理为2SnO2+3C═2Sn+aM↑+CO2↑,则下列说法中错误的是( )
| A、反应中SnO2被还原 |
| B、a的值为3 |
| C、反应后元素化合价升高生成的物质有两种 |
| D、每生成1mol CO2转移电子8 mol |
某同学实际配制的NaOH溶液的浓度偏低,其原因不正确的是( )
| A、使用滤纸称量NaOH固体 |
| B、容量瓶中原来存在少量蒸馏水 |
| C、溶解后的烧杯未经洗涤 |
| D、定容时仰视刻度线 |
9.2g金属钠投入到足量的重水(2H216O)中,则产生的气体中含有( )
| A、0.2 mol中子 |
| B、0.4 mol电子 |
| C、0.2 mol质子 |
| D、0.4 mol分子 |
生活中下列物质的应用或现象解释错误的是( )
| A、食盐可作调味剂,也可作食品防腐剂 |
| B、大量燃烧化石燃料是造成雾霾天气的重要因素之一 |
| C、装饰材料释放的甲醛会造成空气污染 |
| D、磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
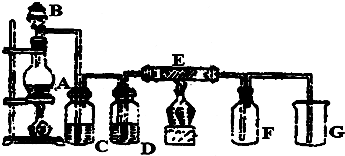





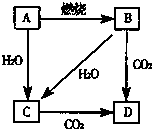 如图中,A是单质,B的焰色反应呈黄色.判断A、B、C、D的化学式:
如图中,A是单质,B的焰色反应呈黄色.判断A、B、C、D的化学式: