题目内容
5.M与N是同素异形体,由M=N;△H=+119KJ/mol可知,M比N稳定(填稳定、不稳定)分析 M与N是同素异形体,由M=N;△H=+119KJ/mol可知,反应过程吸热,N的能量高,物质能量越高越活泼.
解答 解:M与N是同素异形体,由M=N;△H=+119KJ/mol可知,反应过程吸热,N的能量高,则M的稳定性大于N,故答案为:稳定;
点评 本题考查了物质能量变化、物质稳定性判断,注意物质能量越高越活泼,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
16.下列事实不能用勒夏特列原理解释的是( )
| A. | 合成氨工业上增大压强以提高反应物的转化率 | |
| B. | 黄绿色的氯水光照后颜色变浅 | |
| C. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| D. | 在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
13.设 NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 溶有1molFe(OH)3的胶体中,含有NA个Fe(OH)3胶粒 | |
| B. | 在标准状况下,22.4L水的分子数为NA | |
| C. | 常温常压下,14 gC2H4和 C3H6 的混合物含有的氢原子数为2NA | |
| D. | 1molFe与足量Cl2反应,铁失去电子数为2NA |
10.下列化学用语正确的是( )
| A. | 硫化钠的电子式: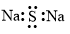 | |
| B. | HClO4的电离方程式:HClO4?H++ClO4- | |
| C. | 乙酸的结构简式:C2H4O2 | |
| D. | Mg2+的结构示意图: |
17.25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 在0.1 mol•L-1Na2S溶液中:2c(Na+)>c(S2-)>c(HS-)>c(OH-) | |
| B. | 一定量的(NH4)2SO4与NH3•H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) | |
| C. | 将0.1 mol•L-1盐酸与0.1 mol•L-1K2CO3溶液等体积混合:c(K+)>c(Cl-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | 将0.1 mol•L-1Na2CO3溶液和0.1 mol•L-1NaHCO3溶液等体积混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
1.硅孔雀石是一种含铜的矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以硅孔雀石为原料制取硫酸铜的工艺流程如图:
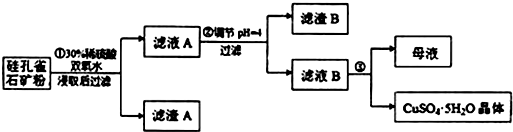
请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式
CuSiO3•2H2O+H2SO4═CuSO4+H4SiO4+H2O;
用离子方程式表示双氧水的作用2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH选用的最佳试剂是B
A.Fe2O3 B.CuO C.Al2O3 D.NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如表:
由上表可知:当溶液pH=4时,可以完全除去的离子是Fe3+,不能完全除去的离子是Al3+.
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会拌有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)该同学的观点是错误的;通过计算可知,滤液B中,c(Al3+)=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出.

请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式
CuSiO3•2H2O+H2SO4═CuSO4+H4SiO4+H2O;
用离子方程式表示双氧水的作用2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH选用的最佳试剂是B
A.Fe2O3 B.CuO C.Al2O3 D.NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会拌有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)该同学的观点是错误的;通过计算可知,滤液B中,c(Al3+)=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出.