题目内容
15.有下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管;⑧细口试剂瓶;⑨标签纸.(1)现需要配制450mL 1mol•L-1硫酸溶液,需用质量分数为98%、密度为1.84g•cm-3的浓硫酸27.2mL.需用500mL 容量瓶.
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是⑤④②⑥⑦⑧⑨.
(3)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”).
①用以稀释硫酸的烧杯未洗涤,偏低.
②未经冷却趁热将溶液注入容量瓶中,偏高.
③定容时观察液面俯视,偏高.
分析 (1)依据配制溶液体积选择合适的容量瓶;依据C=$\frac{1000ρω}{M}$计算浓硫酸物质的量浓度;依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(2)用浓硫酸配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶、贴标签,据此选择使用仪器;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)需要配制450mL 1mol•L-1硫酸溶液,应选择500mL容量瓶;质量分数为98%、密度为1.84g•cm-3的浓硫酸物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=500mL×1mol/L,解得V=27.2mL;
故答案为:27.2 500;
(2)用浓硫酸配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶、贴标签依次用到的仪器:量筒、烧杯、玻璃棒、容量瓶、胶头滴管、细口试剂瓶、标签纸,所以正确的顺序为:⑤④②⑥⑦⑧⑨;
故答案为:⑤④②⑥⑦⑧⑨;
(3)①用以稀释硫酸的烧杯未洗涤,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
②未经冷却趁热将溶液注入容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高;
③定容时观察液面俯视,导致溶液体积皮偏小,溶液浓度偏高;
故答案为:①偏低 ②偏高 ③偏高.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧.

练习册系列答案
相关题目
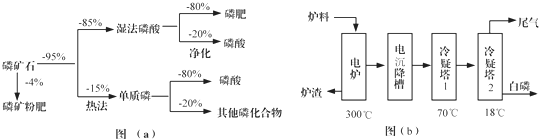
5.磷矿石主要以磷酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3,Ca5(OH)(PO4)3]等形式存在,图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程:
部分物质的相关性质如下:
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
6.单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法正确的是( )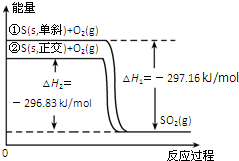

| A. | 单斜硫转化为正交硫的反应是吸热反应 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①表示断裂1mol O2中的共价键所吸收的能量比形成lmolSO2中的共价键所放出的能量少297.16 kJ |
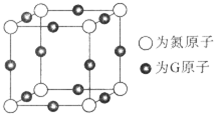 A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都 是2;B、C、D同周期;E核外的s、p能级的电子总数相;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答下列问题:(相关问题用元素符号表示)
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都 是2;B、C、D同周期;E核外的s、p能级的电子总数相;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答下列问题:(相关问题用元素符号表示)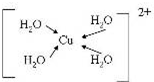 (配位键用→标出).
(配位键用→标出).