题目内容
20.标准状况下,1.7g NH3的体积为2.24L.分析 标准状况下的气体摩尔体积约为22.4L/mol,根据n=$\frac{m}{M}$计算出1.7g氨气的物质的量,再根据V=nVm计算出标准状况下氨气的体积.
解答 解:1.7g NH3的物质的量为:$\frac{1.7g}{17g/mol}$=0.1mol,标准状况下0.1mol氨气的体积为:22.4L/mol×0.1mol=2.24L,
故答案为:2.24.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、摩尔质量之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
11.在反应8NH3+3Cl2=6NH4Cl+N2中,若有2molN2生成,则转移电子的物质的量是( )
| A. | 16mol | B. | 6mol | C. | 12mol | D. | 4mol |
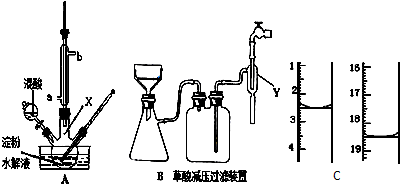
8.某学生发现某试剂瓶中的溶液有浑浊物,用如图所示操作进行,此操作中错误的地方有( )


| A. | 1处 | B. | 2处 | C. | 3处 | D. | 4处 |
12.无色溶液既可能显酸性又可能显碱性,在该溶液中一定能大量共存的离子是( )
| A. | H+ Na+ MnO4- SO42- | B. | Na+ CO32- Mg2+Cl- | ||
| C. | K+Na+ Cl-SO42- | D. | K+ Cl-Ba2+ HCO3- |
9.下列离子方程式表达正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++SO42-+Ba2++4OH-═NH3•H2O+Al(OH)3↓+BaSO4↓ | |
| D. | 酸性溶液中KIO3与KI反应:I-+IO3-+6H+═I2+3H2O |
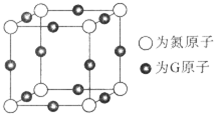 A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都 是2;B、C、D同周期;E核外的s、p能级的电子总数相;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答下列问题:(相关问题用元素符号表示)
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都 是2;B、C、D同周期;E核外的s、p能级的电子总数相;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答下列问题:(相关问题用元素符号表示)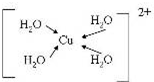 (配位键用→标出).
(配位键用→标出).