题目内容
17.25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是( )| A. | 在0.1 mol•L-1Na2S溶液中:2c(Na+)>c(S2-)>c(HS-)>c(OH-) | |
| B. | 一定量的(NH4)2SO4与NH3•H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) | |
| C. | 将0.1 mol•L-1盐酸与0.1 mol•L-1K2CO3溶液等体积混合:c(K+)>c(Cl-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | 将0.1 mol•L-1Na2CO3溶液和0.1 mol•L-1NaHCO3溶液等体积混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
分析 A.硫化钠溶液中硫离子分步水解溶液显碱性;
B.一定量的(NH4)2SO4与NH3•H2O混合所得的酸性溶液中,一水合氨电离显碱性,铵根水解显酸性;
C.将0.1 mol•L-1盐酸与0.1 mol•L-1K2CO3溶液等体积混合得到等浓度的KHCO3、KCl,碳酸氢根离子水解溶液显碱性;
D.将0.1 mol•L-1Na2CO3溶液和0.1 mol•L-1NaHCO3溶液等体积混合,溶液中存在物料守恒,n(Na)=n(C).
解答 解:A.在0.1 mol•L-1Na2S溶液中S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-:c(Na+)>c(S2-)>c(OH-)>c(HS-),故A错误;
B.一水合氨电离显碱性,铵根水解显酸性,一定量的(NH4)2SO4与NH3•H2O混合所得的酸性溶液中,c(NH4+)<2c(SO42-),故B正确;
C.0.1 mol•L-1盐酸与0.1 mol•L-1K2CO3溶液等体积混合得到等浓度的KHCO3、KCl,碳酸氢根离子水解溶液显碱性,溶液中离子浓度大小:c(K+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+),故C错误;
D.将0.1 mol•L-1Na2CO3溶液和0.1 mol•L-1NaHCO3溶液等体积混合,溶液中存在物料守恒,2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故D错误;
故选B.
点评 本题考查了电解质溶液中离子浓度大小比较、电荷守恒、物料守恒、溶液酸碱性的判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
8.某学生发现某试剂瓶中的溶液有浑浊物,用如图所示操作进行,此操作中错误的地方有( )


| A. | 1处 | B. | 2处 | C. | 3处 | D. | 4处 |
12.无色溶液既可能显酸性又可能显碱性,在该溶液中一定能大量共存的离子是( )
| A. | H+ Na+ MnO4- SO42- | B. | Na+ CO32- Mg2+Cl- | ||
| C. | K+Na+ Cl-SO42- | D. | K+ Cl-Ba2+ HCO3- |
2.某有机物的结构简式为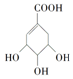 ,关于它的叙述中不正确的是( )
,关于它的叙述中不正确的是( )
 ,关于它的叙述中不正确的是( )
,关于它的叙述中不正确的是( )| A. | 该有机物能使溴的四氯化碳溶液褪色 | |
| B. | 该有机物发生消去反应可得到芳香烃 | |
| C. | 该有机物在一定条件下可发生氧化反应 | |
| D. | 1 mol该有机物最多可与1 mol NaHCO3反应 |
9.下列离子方程式表达正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++SO42-+Ba2++4OH-═NH3•H2O+Al(OH)3↓+BaSO4↓ | |
| D. | 酸性溶液中KIO3与KI反应:I-+IO3-+6H+═I2+3H2O |

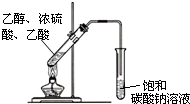 以乙烯为原料,可以制备乙酸乙酯
以乙烯为原料,可以制备乙酸乙酯