题目内容
下列说法正确的是( )
| A、水加热到很高的温度都难分解是因为水分子中存在氢键 |
| B、蔗糖、淀粉、蛋白质及其水解产物均为非电解质 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、不用任何试剂即可鉴别Na2CO3溶液和NaHSO4溶液. |
考点:含有氢键的物质,电解质与非电解质,酯的性质,物质的检验和鉴别的基本方法选择及应用
专题:电离平衡与溶液的pH专题,元素及其化合物
分析:A.水的稳定性与共价键的强弱有关,氢键不属于共价键;
B.蛋白质水解生成氨基酸,为电解质;
C.酯水解时,C-O键断裂;
D.NaHSO4溶液呈酸性,可与碳酸钠溶液反应,试剂加入顺序不同,现象不同.
B.蛋白质水解生成氨基酸,为电解质;
C.酯水解时,C-O键断裂;
D.NaHSO4溶液呈酸性,可与碳酸钠溶液反应,试剂加入顺序不同,现象不同.
解答:
解:A.氢键属于分子间作用力,只影响物质的物理性质,而水的稳定性与共价键的强弱有关,故A错误;
B.蛋白质水解生成氨基酸,为电解质,故B错误;
C.酯水解时,C-O键断裂,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH,故C错误;
D.NaHSO4溶液呈酸性,向NaHSO4溶液中加碳酸钠,开始就生成气体,而向碳酸钠中加NaHSO4溶液,先没有气体后生成气体,现象不同,可鉴别,故D正确.
故选D.
B.蛋白质水解生成氨基酸,为电解质,故B错误;
C.酯水解时,C-O键断裂,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH,故C错误;
D.NaHSO4溶液呈酸性,向NaHSO4溶液中加碳酸钠,开始就生成气体,而向碳酸钠中加NaHSO4溶液,先没有气体后生成气体,现象不同,可鉴别,故D正确.
故选D.
点评:本题考查较为综合,涉及多方面知识,为高频考点,侧重于学生的分析能力的考查,注意把握氢键易共价键的区别,易错点为B,注意氨基酸为弱电解质的性质,难度不大.

练习册系列答案
相关题目
鉴别氯化铁溶液与氢氧化铁胶体最简便的方法是( )
| A、萃取 | B、蒸馏 |
| C、过滤 | D、丁达尔效应 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol-CH3和1 mol OH-都含有10 NA个电子 |
| B、常温常压下,8gCH4含有2NA个共价键 |
| C、1L 0.1 mol?L-1的醋酸溶液中含有0.1NA个H+ |
| D、标准状况下22.4 L 乙醇含碳原子数为NA |
有一包铁粉和铜粉混合物均匀的粉末样品,为了确定其组成,某同学将不同质量的该样品分别与40mL1mol?L-1的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化).
下列实验结论不正确的是( )
| 实验序号 | 一 | 二 | 三 | 四 |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A、实验一反应后溶液中含有Fe3+、Fe2+、Cu2+ |
| B、实验二、三反应后剩余固体全部是Cu |
| C、实验四的滤液中c(Fe2+)=1.5mol?L-1 |
| D、原粉末样品中m(Fe):m(Cu)=7:8 |
下列各组离子一定能大量共存的是( )
| A、醋酸溶液中:K+、Cu2+、Na+、C1-、SO42- | ||
| B、pH=ll的溶液中:HCO3-、Na+、NH3.H2O、NO3- | ||
C、常温下,
| ||
| D、在含有大量Fe3+的溶液中:A13+、Na+、S2-、Br- |
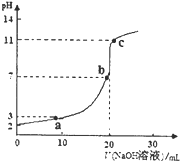 室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )
室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )| A、该一元酸溶液浓度为0.10mol?L-1 |
| B、a、b、c点的水溶液导电性依次增强 |
| C、室温时,HA的电离常数Ka≈1×10-5 |
| D、a点和c点所示溶液中H2O的电离程度相同 |
 ,链烃A能发生如图所示的一系列变化:
,链烃A能发生如图所示的一系列变化:
 所示.试回答下列问题:
所示.试回答下列问题: