题目内容
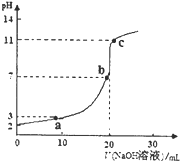 室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )
室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )| A、该一元酸溶液浓度为0.10mol?L-1 |
| B、a、b、c点的水溶液导电性依次增强 |
| C、室温时,HA的电离常数Ka≈1×10-5 |
| D、a点和c点所示溶液中H2O的电离程度相同 |
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:A、根据图象知,当NaOH体积为20mL时二者恰好反应生成盐,则二者的物质的量相等;
B、溶液的导电能力与离子浓度成正比;
C、常温下,HA的电离常数Ka=
;
D、a点c(H+)=0.01mol/L,则由水电离出来的c(OH-)=1.0×10-11,c点c(H+)=1.0×10-11全部由水电离出来.
B、溶液的导电能力与离子浓度成正比;
C、常温下,HA的电离常数Ka=
| [H+]?[A-] |
| [HA] |
D、a点c(H+)=0.01mol/L,则由水电离出来的c(OH-)=1.0×10-11,c点c(H+)=1.0×10-11全部由水电离出来.
解答:
解:A、根据图象知,当NaOH体积为20mL时二者恰好反应生成盐,则二者的物质的量相等,二者的体积相等,则其浓度相等,所以一元酸溶液浓度为0.100 0 mol?L-1,故A正确;
B、溶液的导电能力与离子浓度成正比,HA是弱电解质,NaOH、NaA是强电解质,完全电离,根据图象知,a、b、c点的水溶液中,溶液中自由移动离子浓度逐渐增大,所以其导电性依次增强,故B正确;
C、根据图象知,0.10mol/LHA溶液中pH=2,则c(H+)=0.01mol/L,HA的电离常数Ka=
=
≈1.1×10-3,故C错误;
D、D、a点c(H+)=0.01mol/L,则由水电离出来的c(OH-)=1.0×10-11,c点c(H+)=1.0×10-11全部由水电离出来,故D正确;
故选C.
B、溶液的导电能力与离子浓度成正比,HA是弱电解质,NaOH、NaA是强电解质,完全电离,根据图象知,a、b、c点的水溶液中,溶液中自由移动离子浓度逐渐增大,所以其导电性依次增强,故B正确;
C、根据图象知,0.10mol/LHA溶液中pH=2,则c(H+)=0.01mol/L,HA的电离常数Ka=
| [H+]?[A-] |
| [HA] |
| (0.01)2 |
| 0.1-0.01 |
D、D、a点c(H+)=0.01mol/L,则由水电离出来的c(OH-)=1.0×10-11,c点c(H+)=1.0×10-11全部由水电离出来,故D正确;
故选C.
点评:本题考查了酸碱混合溶液定性判断,明确图象中各个点的含义是解本题关键,结合电荷守恒来分析解答,注意溶液的导电能力与离子浓度的关系,难度中等.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
下列说法不正确的是( )
| A、使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 |
| B、石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
| C、向汽油中添加甲醇后,该混合燃料的热值不变 |
| D、利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
下列说法正确的是( )
| A、水加热到很高的温度都难分解是因为水分子中存在氢键 |
| B、蔗糖、淀粉、蛋白质及其水解产物均为非电解质 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、不用任何试剂即可鉴别Na2CO3溶液和NaHSO4溶液. |
 草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:
草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下: