题目内容
2.现有四种元素的基态原子的外围电子排布式如下:①ns2np3 ②ns2np4 ③ns2np5④ns2np6则下列有关比较中正确的是( )| A. | 原子半径最大的主族元素是④ | B. | 电负性最大的元素是① | ||
| C. | 第一电离能最小的元素是② | D. | ③的最高正化合价一定是+7价 |
分析 A、④是稀有气体不是主族元素;
B、同周期从左到右电负性逐渐增强,所以电负性最大的是③;
C、同周期从左到右第一电离能逐渐增强,位于第ⅡA和第ⅤA族元素第一电离能比同周期相邻元素大;
D、③ns2np5,如果是第二周期的氟,只有负价无正价.
解答 解:A、④是稀有气体不是主族元素,故A错误;
B、同周期从左到右电负性逐渐增强,所以电负性最大的是③,而不是①,故B错误;
C、同周期从左到右第一电离能逐渐增强,位于第ⅡA和第ⅤA族元素第一电离能比同周期相邻元素大,①位于第ⅤA族,所以第一电离能最小的元素是②,故C正确;D、③ns2np5,如果是第二周期的氟,只有负价无正价,故D错误;
故选C.
点评 本题考查核外电子排布规律、元素周期律等,难度不大,注意把握电子排布规律,掌握同周期和同主族元素性质的递变规律.

练习册系列答案
相关题目
18.完成下表空白处
| 原子序数 | 电子排布式 | 在周期表中的位置 | 是金属还是非金属 | 最高价氧化物的水化物及酸碱性 | 气态氢化物的化学式 |
| 15 | |||||
| 1s22s22p63s23p4 | |||||
| 第二周期VA族 |
19.下列离子方程式书写错误的是( )
| A. | 铜片浸入氯化铁溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 一小块钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 稀盐酸滴入硝酸银溶液中:Ag++Cl-═AgCl↓ | |
| D. | 烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O |
16.有机物R是合成某药物的中间体,结构简式如图:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | R分子有3种含氧官能团 | B. | 1molR最多消耗5mol NaOH | ||
| C. | R与氯化铁溶液发生显色反应 | D. | R能发生取代、加成、氧化 |
3.一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )
| A. | 过量的氢气与氮气 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18 mol/L硫酸 |
7.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
| A. | 原子的价电子排布为ns2np1~6的元素一定是主族元素 | |
| B. | 基态原子的p能级上有5个电子的元素一定是ⅦA族元素 | |
| C. | 原子的价电子排布为(n-1)d6~8ns2的元素一定位于ⅢB~ⅦB族 | |
| D. | 基态原子的N层上只有1个电子的元素一定是主族元素 |
11.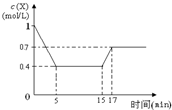 一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )
一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )
 一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )
一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )| A. | 0~5 min时,该反应的速率为v(X)=0.12 mol/(L•min) | |
| B. | 15 min时改变的条件可能是减小压强 | |
| C. | 15 min时改变的条件可能是升高温度 | |
| D. | 从初始到17 min时,X的转化率为30% |
12.下列离子方程式不正确的是( )
| A. | 碳酸氢钠溶液中加入稀盐酸:HCO3-+H+═H2O+CO2↑ | |
| B. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 醋酸与氨水反应:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O | |
| D. | 常温下,用氢氧化钠溶液吸收多余的氯气:Cl2+2OH-═Cl-+ClO-+H2O |
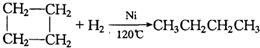
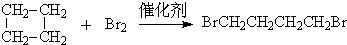 、
、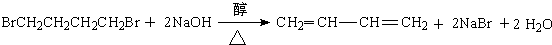 .
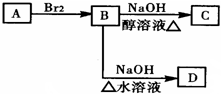
.
 ;C
;C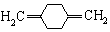 .
.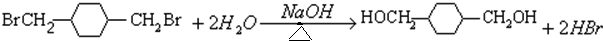 .
.