题目内容
18.完成下表空白处| 原子序数 | 电子排布式 | 在周期表中的位置 | 是金属还是非金属 | 最高价氧化物的水化物及酸碱性 | 气态氢化物的化学式 |
| 15 | |||||
| 1s22s22p63s23p4 | |||||
| 第二周期VA族 |
分析 原子序数等于核外电子数,根据能量最低原理书写电子排布式,主族元素周期数=电子层数、族序数=最外层电子数,15号元素为P;电子排布式为1s22s22p63s23p4,该元素为S元素,第二周期第VA主族元素为N元素,据此解答.
解答 解:15号元素为P,电子排布式为1s22s22p63s23p3,处于第三周期第ⅤA族,是非金属元素,最高价氧化物的水化物为H3PO4,气态氢化物的化学式为PH3;
电子排布式为1s22s22p63s23p4,该元素为S元素,原子序数为16,处于第三周期ⅥA族,是非金属元素,最高价氧化物的水化物为H2SO4,气态氢化物的化学式为H2S;
第二周期第VA主族元素为N元素,电子排布式为1s22s22p3,原子序数为7,是非金属元素,最高价氧化物的水化物为HNO3,气态氢化物的化学式为NH3;
故答案为:
| 原子序数 | 电子排布式 | 在周期表中的位置 | 是金属还是非金属 | 最高价氧化物的水化物及酸碱性 | 气态氢化物的化学式 |
| 15 | 1s22s22p63s23p3 | 第三周期ⅤA族 | 非金属 | H3PO4,酸性 | PH3 |
| 16 | 1s22s22p63s23p4 | 第三周期ⅥA族 | 非金属 | H2SO4,酸性 | H2S |
| 7 | 1s22s22p3 | 第二周期VA族 | 非金属 | HNO3,酸性 | NH3 |
点评 本题考查结构性质位置关系应用,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
6.某原子的最外层电子的轨道排布式中,能量最低的是( )
| A. |  | B. |  | C. |  | D. |  |
3.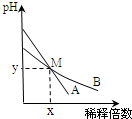 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| C. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH为7 | |
| D. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 |
7.苯甲酸钠(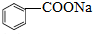 ,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
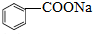 ,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )| A. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| B. | 提高CO2充气压力,饮料中c(A-)不变 | |
| C. | 当pH为5.0时,饮料中$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH-)-c(HA) |
2.现有四种元素的基态原子的外围电子排布式如下:①ns2np3 ②ns2np4 ③ns2np5④ns2np6则下列有关比较中正确的是( )
| A. | 原子半径最大的主族元素是④ | B. | 电负性最大的元素是① | ||
| C. | 第一电离能最小的元素是② | D. | ③的最高正化合价一定是+7价 |
 .
.
 .
.