题目内容
11.甲、乙、丙三位同学分别欲用图所示实验装置制取并收集氨气.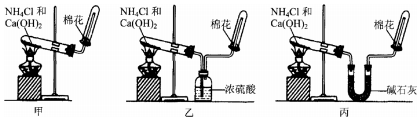
(1)其中有一位同学没有收集到氨气,你认为没有收集到氨气的同学是乙(填“甲”或“乙”或“丙”),原因是浓硫酸吸收氨气.
(2)要制取纯净的氨气,应该选用丙(填“甲”或“乙”或“丙”)同学的装置.为确定试管内是否已收集满氨气,可将蘸浓盐酸的玻璃棒置于收集气体的试管口处,若观察到试管口冒白烟,则说明氨气已收集满.
分析 依据图装置可知三位同学制取氯气方法都是用加热固体 氯化铵和氢氧化钙的方法;
(1)浓硫酸为碱性气体,不能干燥氨气;
(2)要制取纯净的氨气,选择并装置,气体中含有的水蒸气可以通过碱石灰干燥,氨气为碱性气体,能够使石蕊的红色石蕊试纸变蓝,氨气能够与氯化氢反应生成白色固体氯化铵,产生大量白烟,据此检验氨气存在;
解答 解:三位同学制取氯气方法都是用氯化铵和氢氧化钙加热生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,氨气比空气轻,极易溶于水,采用向下排气法收集,氨气是碱性气体用碱石灰干燥气体,
(1)浓硫酸为碱性气体,能够与氨气反应吸收氨气,不能干燥氨气,所以乙同学不能收集到氨气;
故答案为:乙;浓硫酸吸收氨气;
(2)甲装置中生成的氨气含水蒸气,乙装置中氨气和浓硫酸反应不能制备氨气,丙装置中碱石灰干燥氨气,最后得到纯净的氨气,氨气为碱性气体,能够使石蕊的红色石蕊试纸变蓝,氨气能够与氯化氢反应生成白色固体氯化铵,产生大量白烟,所以为确定试管内是否已收集满氨气,用蘸有浓盐酸的玻璃棒置于收集气体的试管口处,若观察到试管口白烟产生,则说明氨气已收集满,反应为:NH3+HCl=NH4Cl,
故答案为;丙;试管口冒白烟.
点评 本题考查氨气的制备,把握氨气的性质、反应原理与反应装置的关系即可解答,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
6.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | SO2溶于水形成的溶液能导电 | SO2是电解质 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键的键角是109.5° |
| C | 1体积水可以溶解700体积氨气 | 氨是极性分子且由于有氢键的影响 |
| D | HF的沸点高于HCI | H-F的键长比H-CI的键长短 |
| A. | SO2溶于水形成的溶液能导电SO2是电解质 | |
| B. | 白磷为正四面体分子白磷分子中P-P键的键角是109.5° | |
| C. | 1体积水可以溶解700体积氨气氨是极性分子且由于有氢键的影响 | |
| D. | HF的沸点高于HCIH-F的键长比H-CI的键长短 |
6.某高中化学实验兴趣小组设计如下实验方案,探究SO2的制备及相关性质实验,实验装置如图所示:
请回答下列问题:
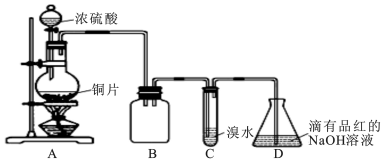
(1)装置B的作用是防倒吸(或安全瓶). 反应过程中圆底烧瓶内的溶液中有一种白色固体析出,为了证明该物质常采用的实验操作及现象为:将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,待实验完成、圆底烧瓶冷却后,若固体溶解,溶液变蓝,则白色固体为硫酸铜.
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-;.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学通过下列实验确定该反应属于哪一种情况,请完成表:
(4)请设计简单实验方案证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kh的相对大小:常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb.
请回答下列问题:

(1)装置B的作用是防倒吸(或安全瓶). 反应过程中圆底烧瓶内的溶液中有一种白色固体析出,为了证明该物质常采用的实验操作及现象为:将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,待实验完成、圆底烧瓶冷却后,若固体溶解,溶液变蓝,则白色固体为硫酸铜.
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-;.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学通过下列实验确定该反应属于哪一种情况,请完成表:
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
16.25℃时,在 10mL 浓度为 0.1mol/L 的 NH3•H2O 溶液中滴加 0.1mol/L 盐酸,下列有关描述正确的是( )
| A. | 加入5 mL 盐酸时:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 加入10mL 盐酸时:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| C. | 在溶液pH=7 时:水的电离程度最大 | |
| D. | 加入20 mL 盐酸时:c(Cl-)=2c(NH4+) |
3.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将铁块放入浓H2SO4中 | 无明显现象发生 | 铁常温下与浓H2SO4不反应 |
| B | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均发生了分解 |
| C | 氯水滴入混有KSCN的FeCl2溶液 | 溶液显红色 | 该氯水不具有漂白性 |
| D | 向溶液Y中先加盐酸酸化,无现象,再加入BaCl2溶液 | 白色沉淀 | Y中一定含SO42- |
| A. | A | B. | B | C. | C | D. | D |
20.把下列四种x溶液分别加入盛有100mL2mol/L盐酸的烧杯中,并加入水稀释至100mL,此时x和盐酸缓缓地进行反应,其中反应速率最大的是( )
| A. | 10℃20 mL3mol/L的x溶液 | B. | 20℃30 mL2mol/L的x溶液 | ||
| C. | 10℃10 mL4mol/L的x溶液 | D. | 10℃20 mL2mol/L的x溶液 |
1.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质 |