题目内容
6.某高中化学实验兴趣小组设计如下实验方案,探究SO2的制备及相关性质实验,实验装置如图所示:请回答下列问题:
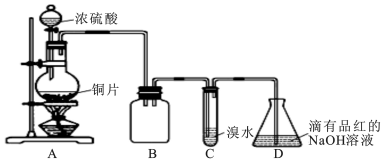
(1)装置B的作用是防倒吸(或安全瓶). 反应过程中圆底烧瓶内的溶液中有一种白色固体析出,为了证明该物质常采用的实验操作及现象为:将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,待实验完成、圆底烧瓶冷却后,若固体溶解,溶液变蓝,则白色固体为硫酸铜.
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-;.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学通过下列实验确定该反应属于哪一种情况,请完成表:
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
分析 由图可知,A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸,C中发生SO2+Br2+2H2O=H2SO4+2HBr,D中NaOH溶液吸收尾气,
(1)B仪器可防止倒吸;反应的溶液中有一种白色固体析出,为了证明该物质常采用的实验方法为将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,若固体溶解,溶液变蓝,则白色固体为硫酸铜,
(2)C中发生的反应中S元素的化合价升高,则设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3时碱性降低,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色;
(3)向NaHSO3溶液中加入NaClO溶液时,反应有I.NaHSO3和NaClO恰好反应:NaHSO3+NaClO=NaHSO4+NaCl;Ⅱ.NaClO不足:2NaHSO3+NaClO=Na2SO4+SO2↑+H2O+NaCl;Ⅲ.NaClO过量:NaHSO3+NaClO=Na2SO4+NaCl+HClO;
①取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡.若固体溶解,产生气泡,则Ⅰ或Ⅱ成立;
②继续向试管A中滴加溴水,充分振荡,若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立
③另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡.HClO可氧化KI;2HClO+2KI=I2+KCl+KClO+H2O,溶液变为蓝色,则Ⅲ成立;
(4)电离显酸性,水解显碱性,则测定pH即可.
解答 解:由图可知,A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸,C中发生SO2+Br2+2H2O=H2SO4+2HBr,D中NaOH溶液吸收尾气,
(1)装置B的作用是防倒吸(或安全瓶),反应的溶液中有一种白色固体析出,为了证明该物质常采用的实验方法为将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,若溶液变蓝,则白色固体为硫酸铜,故答案为:防倒吸(或安全瓶);将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,若固体溶解,溶液变蓝,则白色固体为硫酸铜;
(2)C中发生的反应中S元素的化合价升高,则设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3时碱性降低,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色,故答案为:还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;
(3)向NaHSO3溶液中加入NaClO溶液时,反应有I.NaHSO3和NaClO恰好反应:NaHSO3+NaClO=NaHSO4+NaCl;Ⅱ.NaClO不足:2NaHSO3+NaClO=Na2SO4+SO2↑+H2O+NaCl;Ⅲ.NaClO过量:NaHSO3+NaClO=Na2SO4+NaCl+HClO;
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
(4)电离显酸性,水解显碱性,则测定pH即可,则设计实验为常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb,
故答案为:常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb.
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验装置、原理、物质的性质及反应为解答的关键,侧重分析与实验能力的考查,题目难度中等.

| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由一种元素组成的物质一定是单质,两种元素组成的物质一定是化合物 | |
| C. | 非金属氧化物不一定是酸性氧化物,酸性氧化物不一定都是非金属氧化物 | |
| D. | 硫酸、纯碱、石膏是按酸、碱、盐排列的 |
| A. | 向NaOH溶液中滴加盐酸至完全中和 | |
| B. | 向Ba(OH)2溶液中滴加盐酸至完全中和 | |
| C. | 向Ba(OH)2溶液中滴加硫酸至完全中和 | |
| D. | 向BaCl2溶液中滴加AgNO3至沉淀完全 |
| A. | 0.014 mol | B. | 0.01 mol | C. | 0.007 mol | D. | 0.005 mol |
| A. | 任何条件下,16gCH4与18 g H2O所含有电子数均为10NA | |
| B. | 19g的H3O+离子中含有的电子数为11NA | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
| A. | 电解氯化镁溶液的阴极电极反应式:Mg2++2e-═Mg | |
| B. | 惰性电极电解饱和食盐水:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| C. | 醋酸与乙醇混合、浓硫酸催化加热:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | 硫酸铝和小苏打溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |