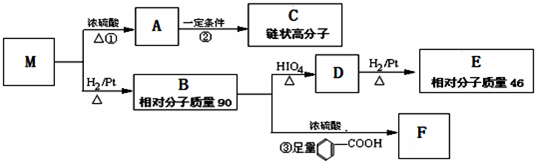
题目内容
200g 9.8%的稀硫酸与足量锌粒反应.
(1)参加反应的锌的物质的量是 mol.
(2)生成氢气的质量为 g.
(3)这些气体中所含的分子数为 .
(4)这些气体在标准状况下的体积是 L.
(1)参加反应的锌的物质的量是
(2)生成氢气的质量为
(3)这些气体中所含的分子数为
(4)这些气体在标准状况下的体积是
考点:化学方程式的有关计算
专题:计算题
分析:发生Zn+H2SO4=ZnSO4+H2↑,硫酸质量为200g×9.8%=19.6g,n(H2SO4)=
=0.2mol,结合反应方程式计算.
| 19.6g |
| 98g/mol |
解答:
解:硫酸质量为200g×9.8%=19.6g,n(H2SO4)=
=0.2mol,
(1)由Zn+H2SO4=ZnSO4+H2↑可知,参加的Zn的物质的量等于硫酸的物质的量,均为0.2mol,故答案为:0.2;
(2)由反应可知,生成0.2mol气体,其质量为0.2mol×2g/mol=0.4g,故答案为:0.4;
(3)由N=nNA可知,气体中所含的分子数为0.2×NA=1.204×1023(或0.2NA),
故答案为:1.204×1023(或0.2NA);
(4)由V=nVm可知,气体在标准状况下的体积是0.2mol×22.4L/mol=4.48L,故答案为:4.48.
| 19.6g |
| 98g/mol |
(1)由Zn+H2SO4=ZnSO4+H2↑可知,参加的Zn的物质的量等于硫酸的物质的量,均为0.2mol,故答案为:0.2;
(2)由反应可知,生成0.2mol气体,其质量为0.2mol×2g/mol=0.4g,故答案为:0.4;
(3)由N=nNA可知,气体中所含的分子数为0.2×NA=1.204×1023(或0.2NA),
故答案为:1.204×1023(或0.2NA);
(4)由V=nVm可知,气体在标准状况下的体积是0.2mol×22.4L/mol=4.48L,故答案为:4.48.
点评:本题考查化学反应方程式的计算,为高频考点,把握发生的化学反应及物质之间的量的关系为解答的关键,侧重分析能力、计算能力的考查,注意以物质的量为中心 的基本计算公式,题目难度不大.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A、SO2、CS2、HI都是直线形的分子 |
| B、BF3键角为120°,SnBr2键角大于120° |
| C、COCl2、BF3、SO3都是平面三角形的分子 |
| D、PCl3、NH3、PCl5都是三角锥形的分子 |
下列各组元素按从左到右的顺序,原子序数递增、元素的最高正化合价也递增的是( )
| A、C、N、O、F |
| B、Na、Be、B、C |
| C、P、S、Cl、Ar |
| D、Na、Mg、Al、Si |
 某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示:
某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示: