题目内容
1.下列物质:(1)Na(2)Br2 (3)Na2O (4)NO2 (5)CO2 (6)SO3 (7)NH3(8)H2S
(9)HCl (10)H2SO4 (11)Ba(OH)2 (12)NaCl (13)蔗糖 (14)NaCl溶液.
属于电解质的是 ,属于非电解质的是 ,能导电的是 .
2.在Fe3O4+4CO
3Fe+4CO2的中, 是氧化剂, 元素被氧化.
3.写出下列物质的电离方程式:NaHSO4 ,H2SO4 ,NH4HCO3 .
4.向Fe(OH)3胶体中逐滴滴入过量的盐酸,会出现一系列变化:先出现 ,原因:
,随后 .原因(用离子方程式表示 .
(9)HCl (10)H2SO4 (11)Ba(OH)2 (12)NaCl (13)蔗糖 (14)NaCl溶液.
属于电解质的是
2.在Fe3O4+4CO
| ||
3.写出下列物质的电离方程式:NaHSO4
4.向Fe(OH)3胶体中逐滴滴入过量的盐酸,会出现一系列变化:先出现
,随后
考点:电解质与非电解质,电离方程式的书写,胶体的重要性质,氧化还原反应
专题:氧化还原反应专题,溶液和胶体专题,电离平衡与溶液的pH专题
分析:(1)电解质在熔融状态或水溶液中能导电的化合物,非电解质是在熔融状态和水溶液中都不能导电的化合物,电解质在熔融状态或水溶液中能导电,金属单质能导电;
(2)Fe元素的化合价降低,C元素的化合价升高,以此来解答;
(3)NaHSO4是强电解质,完全电离,硫酸氢根离子应拆分;
K2SO4是强电解质,完全电离,硫酸根离子应保留;
NH4HCO3是强电解质,完全电离生成铵根离子和碳酸氢根离子;
(4))根据胶体的性质判断,加入盐酸产生聚沉现象;
氢氧化铁胶体聚沉后会产生氢氧化铁沉淀,盐酸和氢氧化铁沉淀反应,生成氯化铁和水;
(2)Fe元素的化合价降低,C元素的化合价升高,以此来解答;
(3)NaHSO4是强电解质,完全电离,硫酸氢根离子应拆分;
K2SO4是强电解质,完全电离,硫酸根离子应保留;
NH4HCO3是强电解质,完全电离生成铵根离子和碳酸氢根离子;
(4))根据胶体的性质判断,加入盐酸产生聚沉现象;
氢氧化铁胶体聚沉后会产生氢氧化铁沉淀,盐酸和氢氧化铁沉淀反应,生成氯化铁和水;
解答:
解:电解质在熔融状态或水溶液中能导电的化合物,包括酸、碱、盐、氧化物等化合物,属于电解质的是:(3)Na2O (8)H2S (9)HCl (10)H2SO4 (11)Ba(OH)2 (12)NaCl;
非电解质是在熔融状态和水溶液中都不能导电的化合物,属于非电解质的是:(4)NO2(5)CO2(6)SO3(7)NH3(13)蔗糖;
(1)Na、(14)NaCl溶液能导电;
故答案为:(3)(8)(9)(10)(11)(12);(4)(5)(6)(7)(13);(1)(14)
(2)Fe3O4+4CO
3Fe+4CO2中,Fe元素的化合价降低,则Fe3O4为氧化剂;C元素的化合价升高,CO为还原剂,在反应中C元素被氧化,
故答案为:Fe3O4;C;
(3)NaHSO4是强电解质,完全电离,电离方程式为NaHSO4=Na++H++SO42-;
H2SO4是强电解质,完全电离,电离方程式为H2SO4=2H++SO42-;
NH4HCO3是强电解质,完全电离,电离方程式为:NH4HCO3=NH4++HCO3-;
故答案为:NaHSO4=Na++H++SO42-;H2SO4=2H++SO42-;NH4HCO3=NH4++HCO3-;
(4)电解质盐酸电离出的Cl-使Fe(OH)3胶体发生聚沉,生成红褐色沉淀,
故答案为:红褐色沉淀;电解质盐酸使Fe(OH)3胶体聚沉而产生沉淀;
②氢氧化铁胶体聚沉后会产生氢氧化铁沉淀,继续加入硫酸,会发生酸碱中和反应,红褐色沉淀溶解,生成氯化铁和水,此反应的离子方程式是Fe(OH)3+3H+═Fe3++3H2O,
故答案为:红褐色沉淀溶解;Fe(OH)3+3H+═Fe3++3H2O;
非电解质是在熔融状态和水溶液中都不能导电的化合物,属于非电解质的是:(4)NO2(5)CO2(6)SO3(7)NH3(13)蔗糖;
(1)Na、(14)NaCl溶液能导电;
故答案为:(3)(8)(9)(10)(11)(12);(4)(5)(6)(7)(13);(1)(14)
(2)Fe3O4+4CO
| ||
故答案为:Fe3O4;C;
(3)NaHSO4是强电解质,完全电离,电离方程式为NaHSO4=Na++H++SO42-;
H2SO4是强电解质,完全电离,电离方程式为H2SO4=2H++SO42-;
NH4HCO3是强电解质,完全电离,电离方程式为:NH4HCO3=NH4++HCO3-;
故答案为:NaHSO4=Na++H++SO42-;H2SO4=2H++SO42-;NH4HCO3=NH4++HCO3-;
(4)电解质盐酸电离出的Cl-使Fe(OH)3胶体发生聚沉,生成红褐色沉淀,
故答案为:红褐色沉淀;电解质盐酸使Fe(OH)3胶体聚沉而产生沉淀;
②氢氧化铁胶体聚沉后会产生氢氧化铁沉淀,继续加入硫酸,会发生酸碱中和反应,红褐色沉淀溶解,生成氯化铁和水,此反应的离子方程式是Fe(OH)3+3H+═Fe3++3H2O,
故答案为:红褐色沉淀溶解;Fe(OH)3+3H+═Fe3++3H2O;
点评:本题考查电解质和非电解质、电离方程式的书写,Fe(OH)3胶体的制备知识,注意氢氧化铁胶体的聚沉以及沉淀的溶解原因是解答(4)的关键,题目难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
下列关于叙述正确的是( )
| A、物质的量是含有一定数目粒子的集合体 |
| B、摩尔质量就是该物质的相对分子质量或相对原子质量 |
| C、单位物质的量的物质所占的体积就是气体摩尔体积 |
| D、40gNaOH溶解在1L水中,形成溶液溶质的物质的量浓度为1mol/L |
天津是我国研发和生产锂离子电池的重要基地.锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6
CoO2+LiC6,下列说法正确的是( )
| ||
| 放电 |
| A、上述反应为可逆反应 |
| B、放电时,电池的正极反应为CoO2+Li++e-=LiCoO2 |
| C、锂离子电池可以用水溶液来做电解质溶液 |
| D、锂离子电池的比能量(单位质量释放的能量)低 |
在标准状况下,相同体积的H2、O2、N2三种气体,有关叙述正确的是( )
| A、分子数相同 | B、质量相同 |
| C、原子数相同 | D、密度相同 |
 为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.
为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.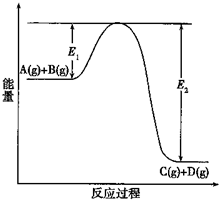 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.