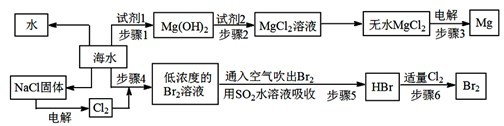
题目内容
 某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示:
某化学兴趣小组同学用实验室中一瓶久置的NaOH固体做了以下实验:先称取13.3g NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入浓度为4mol?L-1的盐酸,再根据生成的CO2体积计算出Na2CO3质量,从而进一步计算出样品中变质NaOH的质量.实验测得加入盐酸的体积与产生CO2的体积(标况)关系如图所示:(1)13.3g该样中未变质的NaOH的质量为
(2)与NaOH反应消耗的盐酸体积为
考点:有关混合物反应的计算,化学方程式的有关计算
专题:计算题
分析:(1)由图可知,生成二氧化碳为1.12L,生成二氧化碳的总反应为:Na2CO3+2HCl═2NaCl+H2O+CO2↑,据此计算样品中碳酸钠等质量,进而计算氢氧化钠的质量;
(2)根据NaOH+HCl=NaCl+H2O计算氢氧化钠消耗HCl的物质的量,再根据V=
计算消耗盐酸的体积.
(2)根据NaOH+HCl=NaCl+H2O计算氢氧化钠消耗HCl的物质的量,再根据V=
| n |
| c |
解答:
解:(1)由图可知,生成二氧化碳为1.12L,则:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106g 22.4L
m(Na2CO3) 1.12L
故m(Na2CO3)=
=5.3g
故样品中氢氧化钠的质量=13.3g-5.3g=8g
故答案为:8g;
(2)8g氢氧化钠的物质的量=
=0.2mol,则:
NaOH+HCl=NaCl+H2O
0.2mol 0.2mol
故氢氧化钠消耗盐酸的体积=
=0.05L=50mL
故答案为:50mL.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106g 22.4L
m(Na2CO3) 1.12L
故m(Na2CO3)=
| 106g×1.12L |
| 22.4L |
故样品中氢氧化钠的质量=13.3g-5.3g=8g
故答案为:8g;
(2)8g氢氧化钠的物质的量=
| 8g |
| 40g/mol |
NaOH+HCl=NaCl+H2O
0.2mol 0.2mol
故氢氧化钠消耗盐酸的体积=
| 0.2mol |
| 4mol/L |
故答案为:50mL.
点评:本题考查混合物计算,明确各阶段发生的反应是关键,注意利用总反应方程式简化计算过程,难度不大.

练习册系列答案
相关题目
在标准状况下,相同体积的H2、O2、N2三种气体,有关叙述正确的是( )
| A、分子数相同 | B、质量相同 |
| C、原子数相同 | D、密度相同 |
 为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.
为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.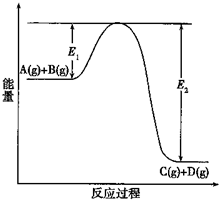 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.