题目内容
在一定温度下,10L密闭容器中通入X和Y各0.16mol,发生如下反应:
X(g)+Y(g)?2Z(g)
一段时间后达到平衡,测得数据如下:
请回答:
(1)2min内,v(Y)= mol/(L?min).
(2)若降低温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应.
(3)该温度下反应的化学平衡常数数值为 .
(4)X的平衡转化率是 .
X(g)+Y(g)?2Z(g)
一段时间后达到平衡,测得数据如下:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)2min内,v(Y)=
(2)若降低温度能使化学平衡向正反应方向移动,则正反应是
(3)该温度下反应的化学平衡常数数值为
(4)X的平衡转化率是
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)依据化学反应速率概念计算,V=
计算得到;
(2)依据化学平衡移动原理分析,降低温度平衡向放热反应方向进行;
(3)依据化学平衡常数概念计算,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(4)转化率=
×100%.
| △c |
| △t |
(2)依据化学平衡移动原理分析,降低温度平衡向放热反应方向进行;
(3)依据化学平衡常数概念计算,用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
(4)转化率=
| 消耗量 |
| 起始量 |
解答:
解:(1)图表分析,2min内,Y物质的量变化=0.16mol-0.12mol=0.04mol,v(Y)=
=0.002mol/L?min,
故答案为:0.002;
(2)降低温度平衡向放热反应方向进行,降低温度能使化学平衡向正反应方向移动说明正反应为放热反应,
故答案为:放热;
(3)图表数据可知7min达到平衡状态,
X(g)+Y(g)?2Z(g)
起始量(mol/L) 0.016 0.016 0
变化量(mol/L) 0.006 0.006 0.012
平衡量(mol/L) 0.01 0.01 0.012
K=
=1.44,
故答案为:1.44,
(4)依据(3)计算X的平衡转化率=
×100%=37.5%,故答案为:37.5%.
| ||
| 2min |
故答案为:0.002;
(2)降低温度平衡向放热反应方向进行,降低温度能使化学平衡向正反应方向移动说明正反应为放热反应,
故答案为:放热;
(3)图表数据可知7min达到平衡状态,
X(g)+Y(g)?2Z(g)
起始量(mol/L) 0.016 0.016 0
变化量(mol/L) 0.006 0.006 0.012
平衡量(mol/L) 0.01 0.01 0.012
K=
| 0.0122 |
| 0.01×0.01 |
故答案为:1.44,
(4)依据(3)计算X的平衡转化率=
| 0.006mol/L |
| 0.016mol/L |
点评:本题考查了化学平衡计算应用,主要是平衡常数,转化率概念的计算应用,平衡移动原理和平衡计算方法是解题关键,题目难度中等.

练习册系列答案
相关题目
天津是我国研发和生产锂离子电池的重要基地.锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6
CoO2+LiC6,下列说法正确的是( )
| ||
| 放电 |
| A、上述反应为可逆反应 |
| B、放电时,电池的正极反应为CoO2+Li++e-=LiCoO2 |
| C、锂离子电池可以用水溶液来做电解质溶液 |
| D、锂离子电池的比能量(单位质量释放的能量)低 |
下列事实,不能用勒夏特列原理解释的是( )
| A、氨水中加酸有利于NH+4的增多 |
| B、H2、Br2、HBr平衡混合气体加压后颜色变深 |
| C、增大压强有利于二氧化硫生成三氧化硫的反应 |
| D、升温不利于合成氨的反应 |
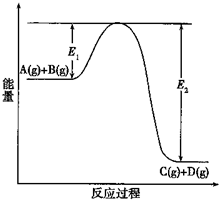 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.