题目内容
近些年来,世界各地频现种种极端天气.二氧化碳、氮氧化物、二氧化硫等是导致极端天气的重要因素,研究这些化合物的综合处理具有重要意义.
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)△H<0,该反应在 (填“较高温度”或“较低温度”)下能自发进行.
(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0
第2步:NH2COONH4(s)?CO(NH2)2(l)+H2O(l)△H2>0
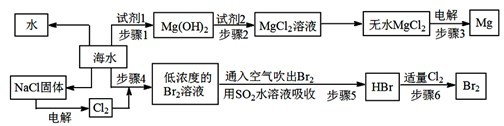
下列示意图中[a表示2NH3(g)+CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号) .
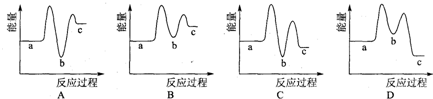
(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3的转化率随时间的变化关系如图所示.
①A点的逆反应速率v逆(CO2) B点的逆反应速率v逆(CO2)(填“<”“>”或“=”).
②达到平衡时,CO2的转化率为 .
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式 .
②上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2.计算K1= ,根据题给信息判断,T1和T2的关系是 .
A.T1>T2 B.T1<T2 C.无法比较
③若密闭容器为容积可变,根据化学反应原理,分析增加压强对该反应的影响 .
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)△H<0,该反应在
(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0
第2步:NH2COONH4(s)?CO(NH2)2(l)+H2O(l)△H2>0
下列示意图中[a表示2NH3(g)+CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号)

(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3的转化率随时间的变化关系如图所示.

①A点的逆反应速率v逆(CO2)
②达到平衡时,CO2的转化率为
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
| 物质 n/mol T/℃ |
活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2.计算K1=
A.T1>T2 B.T1<T2 C.无法比较
③若密闭容器为容积可变,根据化学反应原理,分析增加压强对该反应的影响
考点:化学平衡的计算,反应热和焓变
专题:化学反应中的能量变化,化学平衡专题
分析:(1)依据反应自发进行的判断依据△H-T△S<0分析判断;
(2)根据反应物和生成物的能量高低与反应吸放热之间的关系来判断;
(3)①由CO2的转化率随时间变化图可知,在A点时反应还未达到平衡状态,反应仍将继续正向进行;
②利用三段式法计算;
(4)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
②计算各气体的平衡浓度,代入平衡常数表达式计算;由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
③根据平衡移动原理分析解答;
(2)根据反应物和生成物的能量高低与反应吸放热之间的关系来判断;
(3)①由CO2的转化率随时间变化图可知,在A点时反应还未达到平衡状态,反应仍将继续正向进行;
②利用三段式法计算;
(4)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
②计算各气体的平衡浓度,代入平衡常数表达式计算;由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
③根据平衡移动原理分析解答;
解答:
解:(1)2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)△H<0,△S<0,低温下满足△H-T△S<0,反应自发进行;
故答案为:较低温度;
(2)当反应物的能量高于生成物的能量时,反应是放热反应,当反应物的能量低于生成物的能量时,反应是吸热反应,据反应Ⅰ:2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0
反应Ⅱ:NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2>0,可以知道2NH3(g)和CO2(g)的能量和高于NH2COONH4(s)的能量,NH2COONH4(s)的能量低于CO(NH2)2(I)+H2O(I)的能量,故选C.
故答案为:C;
(3)①由CO2的转化率随时间变化图可知,在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率;
故答案为:<,
②设NH3的初始物质的量为a,CO2的初始物质的量为2a,则,
2NH3+CO2
CO(NH2)2+H2O
起始/mol a 2a
转化/mol 0.6a 0.3a
平衡/mol 0.4a 1.7a
平衡时CO2转化率为=
×100%=15%,
故答案为:15%;
(4)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO?N2+CO2;
故答案为:C+2NO?N2+CO2;
②平衡时c(NO)=
=0.02mol/L,c(N2)=c(CO2)=
=0.015mol/L,故T1℃时该反应的平衡常数为K1=
=
,故答案为:
;
由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:C;
③C+2NO?N2+CO2,反应前后气体体积不变,增大压强,平衡不动,该反应气体分子总数不变,反应速率增大;
故答案为:该反应气体分子总数不变,在其他条件不变时,压强升高,平衡不会移动,NO的转化率不会改变,压强升高,使NO浓度增加,反应速率增大;
故答案为:较低温度;
(2)当反应物的能量高于生成物的能量时,反应是放热反应,当反应物的能量低于生成物的能量时,反应是吸热反应,据反应Ⅰ:2NH3(g)+CO2(g)?NH2COONH4(s)△H1<0
反应Ⅱ:NH2COONH4(s)?CO(NH2)2(I)+H2O(I)△H2>0,可以知道2NH3(g)和CO2(g)的能量和高于NH2COONH4(s)的能量,NH2COONH4(s)的能量低于CO(NH2)2(I)+H2O(I)的能量,故选C.
故答案为:C;
(3)①由CO2的转化率随时间变化图可知,在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率;
故答案为:<,
②设NH3的初始物质的量为a,CO2的初始物质的量为2a,则,
2NH3+CO2
| ||
起始/mol a 2a
转化/mol 0.6a 0.3a
平衡/mol 0.4a 1.7a
平衡时CO2转化率为=
| 0.3a |
| 2a |
故答案为:15%;
(4)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO?N2+CO2;
故答案为:C+2NO?N2+CO2;
②平衡时c(NO)=
| 0.04mol |
| 2L |
| 0.03mol |
| 2L |
| 0.015×0.015 |
| 0.022 |
| 9 |
| 16 |
| 9 |
| 16 |
由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:C;
③C+2NO?N2+CO2,反应前后气体体积不变,增大压强,平衡不动,该反应气体分子总数不变,反应速率增大;
故答案为:该反应气体分子总数不变,在其他条件不变时,压强升高,平衡不会移动,NO的转化率不会改变,压强升高,使NO浓度增加,反应速率增大;
点评:本题是一道关于化学反应能量变化,化学反应速率和化学平衡移动的总合考查题,主要考查了化学平衡移动原理应用,平衡常数计算,考查学生分析和解决问题的能力,难度中等.

练习册系列答案
相关题目
下列物质加入水中,不能形成电解质溶液的是( )
| A、NH3 |
| B、C2H5OH(乙醇) |
| C、NaCl |
| D、HCl |
 一定量CO2通入2L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述不正确的是( )
一定量CO2通入2L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述不正确的是( )| A、通入的CO2气体在标准状况下的体积约为22.4 L |
| B、原溶液中c(NaOH)=2mol/L |
| C、A溶液中含Na2CO3和NaHCO3 各1mol |
| D、A溶液中含有2molNaOH和1mol Na2CO3 |
 为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.
为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.