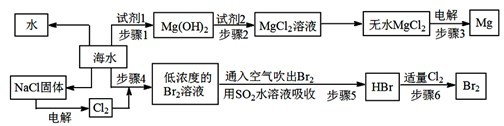
题目内容
电离平衡常数是衡量弱电解质电离程度强弱的量.
已知如表数据.
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 .
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”).
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 .
已知如表数据.
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的pH越小;
(4)根据溶液中氢离子浓度与氢氧根离子浓度的关系,及电荷守恒分析;
(5)根据电离常数大小分析反应的生成物.
(4)根据溶液中氢离子浓度与氢氧根离子浓度的关系,及电荷守恒分析;
(5)根据电离常数大小分析反应的生成物.
解答:
解:(1)根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3溶液>NaCN溶液>CH3COONa溶液;
故答案为:Na2CO3溶液>NaCN溶液>CH3COONa溶液;
(2)等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(H+)<c(OH-)由电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
得c(Na+)>c(CH3COO-);
故答案为:>;
(3)向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,
故答案为:NaCN+H2O+CO2=HCN+NaHCO3.
故答案为:Na2CO3溶液>NaCN溶液>CH3COONa溶液;
(2)等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(H+)<c(OH-)由电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
得c(Na+)>c(CH3COO-);
故答案为:>;
(3)向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,
故答案为:NaCN+H2O+CO2=HCN+NaHCO3.
点评:本题考查盐类水解的应用,溶液中离子浓度的大小比较,综合性较强.要注意碳酸是二元弱酸分步电离,第二部电离比HCN小.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在标准状况下,相同体积的H2、O2、N2三种气体,有关叙述正确的是( )
| A、分子数相同 | B、质量相同 |
| C、原子数相同 | D、密度相同 |
将等质量的锌粒(wg)分别投入VL pH=2的盐酸和醋酸(含醋酸n mol),结果发现一种溶液中Zn有剩余,有关叙述正确的是( )
| A、0.325V<w<32.5n |
| B、产生H2的平均反应速率盐酸大于醋酸 |
| C、产生H2的量盐酸多于醋酸 |
| D、与醋酸反应时锌有剩余 |