题目内容
13.雾霾天气是一种大气污染状态,其污染的来源多种多样,如汽车尾气、工业排放、建筑扬尘、垃圾焚烧等.(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.
①已知部分化学键的键能如下
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
2NO(g)+2CO(g)?N2(g)+2CO2(g) Q=-538KJ
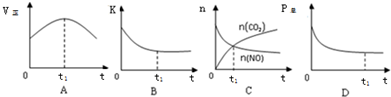
②若上述反应在恒温、恒容的密闭体系中进行,t1时刻达到平衡状态,则下列示意图不符合题意的是ABC(填选项序号).
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.
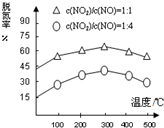
在氨气足量的情况下,不同c(NO2)/c(NO),不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答:温度对脱氮率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小.
NH4Al (SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(3)NH4Al(SO4)2可作净水剂,其理由是Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水.(用必要的方程式说明);相同条件下,0.1mol•L-1 NH4HSO4中c(NH4+)>(填“=”、“>”或“<”)0.1mol•L-1NH4Al(SO4)2中c(NH4+).

(4)如图1是0.1mol•L-1电解质溶液的pH随温度变化的图象.①其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是A(填写字母);
(5)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
分析 (1)①化学反应的焓变等于反应物旧键断裂吸收的能量和产物中新键生成释放的能量之差,据此回答计算;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)根据图示得到温度和脱氮率的关系300℃之前,温度升高脱氮率逐渐增大;300℃之后,温度升高脱氮率逐渐减小;
(3)Al3+水解生成的Al(OH)3具有吸附性;NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
(4)NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
(5)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.
解答 解:(1)①化学反应的焓变等于反应物旧键断裂吸收的能量和产物中新键生成释放的能量之差,所以2NO(g)+2CO( g)?N2( g)+2CO2(g)的△H=(2×632+1072×2)-(750×4+946)kJ/mol=-538kJ/mol,故答案为:-538;
②A、t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误;
B、平衡常数只受温度的影响,反应在恒温、恒容的密闭体系中进行,K始终不变,故B错误;
C、t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C错误;
D、反应前后气体的系数和变化,所以总压不变的状态达到了平衡状态,故D正确;
故选ABC;
(2)根据图示信息得到:300℃之前,温度升高脱氮率逐渐增大;300℃之后,温度升高脱氮率逐渐减小,这是因为:300℃之前,反应未平衡,反应向右进行,脱氮率增大;300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小,
故答案为:300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小;
(3)Al3+水解生成的Al(OH)3具有吸附性,离子方程式:Al3++3H2O═Al(OH)3+3H+,Al(OH)3,NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,
故答案为:Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;>;
(4)NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为A,
故答案为:A;
(5)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查了盖斯定律的应用、化学平衡状态的判断、盐类的水解和离子浓度大小的比较知识,题目难度较大,注意电解质溶液中离子浓度大小和电荷守恒守恒的分析应用.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案| A. | 非金属两原子间不可能形成离子键 | |
| B. | 非金属元素不可能形成离子化合物 | |
| C. | 含有非极性键的分子,不一定是共价化合物 | |
| D. | 离子化合物中一定不含共价键 |
| A. | 干冰灭火剂 | B. | 沙土 | C. | 干粉灭火剂 | D. | 泡沫灭火剂 |
| A. | Zn | B. | Zn(OH)2 | C. | MnO2 | D. | MnOOH |
| A. | 由水电离出的c(H+)=1.0×10-2mol•L-1 | |
| B. | 醋酸的电离平衡常数Ka=c(CH3COO-)•c(H+) | |
| C. | 若将溶液的温度升高到100℃,c(OH-)减小 | |
| D. | 加水稀释后H+的物质的量增加 |
已知:C3H8(g)═CH4(g)+C2H2(g)+H2(g)△H1=+156.6kJ•mol-1
C3H6 (g)═CH4(g)+C2H2(g)△H2=+32.4kJ•mol-1
则相同条件下,反应C3H8(g)═C3H6 (g)+H2(g) 的△H 正确是( )
| A. | △H=一124.2kJ•mol-1 | B. | △H=+124.2kJ•mol-1 | ||
| C. | △H=+248.4kJ•mol-1 | D. | 不能确定 |
| A. | 为防止催化剂中毒,炉气在进入接触室之前需要净化 | |
| B. | 为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ | |
| C. | 为防止污染大气,从吸收塔出来的尾气常用稀氨水吸收 | |
| D. | 为提高SO3的吸收效率,用稀硫酸代替水吸收SO3. |