题目内容
1.碱性锌锰电池是最常见的一次电池,它的总反应如下:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH由此可知,该电池放电时的负极材料是( )| A. | Zn | B. | Zn(OH)2 | C. | MnO2 | D. | MnOOH |
分析 原电池中,失电子的电极是负极,发生氧化反应,据此回答.
解答 解:根据总反应Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH可知,原电池中Zn转化为Zn(OH)2,Zn化合价升高,失电子,做负极,
故选A.
点评 本题考查学生原电池的工作原理以及应用知识,注意基础知识的迁移应用是关键,难度中等.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
12.锌锰干电池是家庭常用的电池,该电池工作时发生的化学反应为Zn+2NH4Cl+2MnO2═Zn(NH3)2Cl2+2MnO(OH),下列说法正确的是( )
| A. | 电池工作时锌片作为正极 | |
| B. | 电池工作时从负极向外电路输出电子 | |
| C. | 电池工作时MnO2发生还原反应 | |
| D. | 电池工作时电能向化学能转化 |
9.下列各组离子能在溶液中大量共存的是( )
| A. | K+、Na+、NO3-、SO42- | B. | Al3+、OH-、Cl-、Na+ | ||
| C. | NO3-、Cl-、Na+、Ag+ | D. | CO32-、H+、Ca2+、Na+ |
16.下列溶液一定呈碱性的是( )
| A. | c(OH-)<c(H+) | B. | 溶液中c(OH-)>c(H+) | ||
| C. | c(OH-)=c(H+) | D. | c(OH-)>1×10-7mol/L |
6.下列说法正确的是( )
| A. | 非自发反应在任何条件下都不能发生 | |
| B. | 冰融化为水的过程中△H<0,△S>0 | |
| C. | 2H2(g)+02(g)=2H2O(l)△H=-572kJ•mol-1此反应在低温时可以自发进行 | |
| D. | 知道了某过程有自发性之后,可预测过程发生完成的快慢 |
13.雾霾天气是一种大气污染状态,其污染的来源多种多样,如汽车尾气、工业排放、建筑扬尘、垃圾焚烧等.
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.
①已知部分化学键的键能如下
请完成汽车尾气净化中发生反应的热化学方程式
2NO(g)+2CO(g)?N2(g)+2CO2(g) Q=-538KJ
②若上述反应在恒温、恒容的密闭体系中进行,t1时刻达到平衡状态,则下列示意图不符合题意的是ABC(填选项序号).
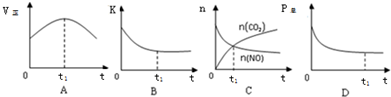
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.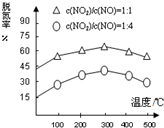
在氨气足量的情况下,不同c(NO2)/c(NO),不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答:温度对脱氮率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小.
NH4Al (SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(3)NH4Al(SO4)2可作净水剂,其理由是Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水.(用必要的方程式说明);相同条件下,0.1mol•L-1 NH4HSO4中c(NH4+)>(填“=”、“>”或“<”)0.1mol•L-1NH4Al(SO4)2中c(NH4+).

(4)如图1是0.1mol•L-1电解质溶液的pH随温度变化的图象.①其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是A(填写字母);
(5)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.
①已知部分化学键的键能如下
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
2NO(g)+2CO(g)?N2(g)+2CO2(g) Q=-538KJ
②若上述反应在恒温、恒容的密闭体系中进行,t1时刻达到平衡状态,则下列示意图不符合题意的是ABC(填选项序号).

(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.

在氨气足量的情况下,不同c(NO2)/c(NO),不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答:温度对脱氮率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小.
NH4Al (SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(3)NH4Al(SO4)2可作净水剂,其理由是Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水.(用必要的方程式说明);相同条件下,0.1mol•L-1 NH4HSO4中c(NH4+)>(填“=”、“>”或“<”)0.1mol•L-1NH4Al(SO4)2中c(NH4+).

(4)如图1是0.1mol•L-1电解质溶液的pH随温度变化的图象.①其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是A(填写字母);
(5)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
10.物质的转化在给定条件下能实现的是( )
| A. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHCO3(s)$\stackrel{△}{→}$Na2CO3(s) | B. | CuCl2$\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{乙醛}$Cu | ||
| C. | Al$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{△}{→}$NaAlO2(s) | D. | Al2O3(s)$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{通电}{→}$Al(s) |






 .
.