题目内容
6.二氧化硫的催化氧化是放热反应,下列关于接触法制硫酸的叙述中正确的是( )| A. | 为防止催化剂中毒,炉气在进入接触室之前需要净化 | |
| B. | 为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ | |
| C. | 为防止污染大气,从吸收塔出来的尾气常用稀氨水吸收 | |
| D. | 为提高SO3的吸收效率,用稀硫酸代替水吸收SO3. |
分析 A.生产分三步,二氧化硫的制取和净化、二氧化硫转化为三氧化硫、三氧化硫的吸收,分别在沸腾炉、接触室、吸收塔中进行;其中从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒;
B.二氧化硫与氧气反应生成三氧化硫为放热反应,高温的目的是考虑催化剂的活性;
C.尾气中的SO2通常用足量氨水吸收;
D.工业上在吸收塔内用浓硫酸吸收,防止形成酸雾阻止充分吸收.
解答 解:A.制备硫酸过程中,从沸腾炉中出来的气体需要净化和干燥,是为了防止在接触室中的催化剂中毒,故A正确;
B.二氧化硫与氧气反应生成三氧化硫为放热反应,所以低温有利于提高二氧化硫转化率,接触室内反应温度选定在400℃~500℃是考虑催化剂活性,故B错误;
C.为防止污染大气,从吸收塔出来的尾气常用氨水吸收,故C正确;
D.工业上在吸收塔内用浓硫酸吸收,防止形成酸雾阻止充分吸收;稀硫酸吸收容易形成酸雾,故D错误.
故选:AC.
点评 本题考查了硫酸的工业制备方法,熟悉硫酸制备的工艺流程及二氧化硫与氧气合成三氧化硫特点是解题关键,题目难度不大.

练习册系列答案
相关题目
13.雾霾天气是一种大气污染状态,其污染的来源多种多样,如汽车尾气、工业排放、建筑扬尘、垃圾焚烧等.
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.
①已知部分化学键的键能如下
请完成汽车尾气净化中发生反应的热化学方程式
2NO(g)+2CO(g)?N2(g)+2CO2(g) Q=-538KJ
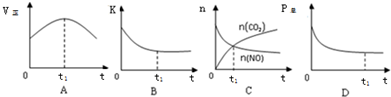
②若上述反应在恒温、恒容的密闭体系中进行,t1时刻达到平衡状态,则下列示意图不符合题意的是ABC(填选项序号).
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.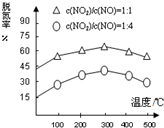
在氨气足量的情况下,不同c(NO2)/c(NO),不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答:温度对脱氮率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小.
NH4Al (SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(3)NH4Al(SO4)2可作净水剂,其理由是Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水.(用必要的方程式说明);相同条件下,0.1mol•L-1 NH4HSO4中c(NH4+)>(填“=”、“>”或“<”)0.1mol•L-1NH4Al(SO4)2中c(NH4+).

(4)如图1是0.1mol•L-1电解质溶液的pH随温度变化的图象.①其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是A(填写字母);
(5)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.
①已知部分化学键的键能如下
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
2NO(g)+2CO(g)?N2(g)+2CO2(g) Q=-538KJ
②若上述反应在恒温、恒容的密闭体系中进行,t1时刻达到平衡状态,则下列示意图不符合题意的是ABC(填选项序号).

(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.

在氨气足量的情况下,不同c(NO2)/c(NO),不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答:温度对脱氮率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小.
NH4Al (SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(3)NH4Al(SO4)2可作净水剂,其理由是Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水.(用必要的方程式说明);相同条件下,0.1mol•L-1 NH4HSO4中c(NH4+)>(填“=”、“>”或“<”)0.1mol•L-1NH4Al(SO4)2中c(NH4+).

(4)如图1是0.1mol•L-1电解质溶液的pH随温度变化的图象.①其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是A(填写字母);
(5)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
17.下列说法正确的是( )
| A. | 放热反应发生的过程中,只放出能量 | |
| B. | 化学反应中的能量通常表现为热量的变化 | |
| C. | 锌与盐酸反应是吸热的过程 | |
| D. | 反应物的总能量高于生成物的总能量为吸热反应 |
1.向四个体积相同的密闭容器中分别充入一定量的SO2和O2,
甲:500℃,10mol SO2和5mol O2反应;
乙:500℃,V2O5作催化剂,10mol SO2和5mol O2反应;
丙:450℃,8mol SO2和5mol O2反应;
丁:500℃,8mol SO2和5mol O2反应,
开始反应时,按反应速率由大到小的排列顺序正确的是( )
甲:500℃,10mol SO2和5mol O2反应;
乙:500℃,V2O5作催化剂,10mol SO2和5mol O2反应;
丙:450℃,8mol SO2和5mol O2反应;
丁:500℃,8mol SO2和5mol O2反应,
开始反应时,按反应速率由大到小的排列顺序正确的是( )
| A. | 甲、乙、丙、丁 | B. | 乙、甲、丙、丁 | C. | 乙、甲、丁、丙 | D. | 丁、丙、乙、甲 |
18.已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量.其他相关数据如表:
则表中x为( )
| O═O | H-H | H-O(g) | |
| 1 mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
| A. | 920 | B. | 557 | C. | 463 | D. | 188 |
16.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
| A. | 将CO2通入水中 | B. | 氯化钠溶于水 | C. | 将HCl通入水中 | D. | 过氧化钠溶于水 |
 .
. .
. .
.