题目内容
7.下列叙述中正确的是( )| A. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 3.4 g NH3中含N-H键数目为0.2NA | |
| C. | 电解精炼铜的过程中,粗铜与电源的负极相连 | |
| D. | CaC2阴阳离子的数目比为1:2 |
分析 A.S2和S8都是由S原子构成,以及n=$\frac{m}{M}$计算解答;
B.质量转化为物质的量,结合1个氨气分子中含有3个N-H解答;
C.粗铜与电源正极相连做电解池的阳极;
D.CaC2中,阴离子为C22-.
解答 解:A.S2和S8的混合物中只有S原子,则硫原子的物质的量为$\frac{6.4g}{32g/mol}$=0.2mol,则所含硫原子数一定为0.2NA,故A正确;
B.3.4 g NH3物质的量为$\frac{3.4g}{17g/mol}$=0.2mol,含有N-H键数目为0.2mol×3×NA=0.6NA,故B错误;
C.电解精炼铜时,将粗铜与电源的正极相连,做电解池的阳极,失电子发生氧化反应,故C错误;
D.CaC2阴阳离子的数目比为1:1,故D错误;
故选:A.
点评 本题为综合题,考查了物质的量的有关计算,电解法精炼铜,明确物质的构成及电解原理是解题关键,注意碳化钙结构特点,题目难度中等.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
17.下列有关叙述正确的是( )
| A. | 常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) | |
| B. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 | |
| C. | 常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小 | |
| D. | 25℃时,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,Ag2CrO4先析出 |
18.杜布纳联合研究所使用粒子回旋加速器,用${\;}_{20}^{48}$Ca轰击${\;}_{97}^{249}$Bk(锫)生成${\;}_{117}^{293}$UP和${\;}_{117}^{294}$UP,Up就是科学家一直寻找的第117号元素.下列有关说法正确的是( )
| A. | ${\;}_{97}^{249}$Bk(锫)中的中子数为97 | |
| B. | ${\;}_{117}^{293}$UP和${\;}_{117}^{294}$UP互为同位素 | |
| C. | 用 ${\;}_{20}^{48}$Ca轰击${\;}_{97}^{249}$Bk的变化是化学变化 | |
| D. | ${\;}_{20}^{48}$Ca、${\;}_{97}^{249}$Bk、${\;}_{117}^{293}$UP、${\;}_{117}^{294}$UP属于四种元素 |
15.对溶液中的离子反应有下列说法:①不可能是氧化还原反应;②只能是复分解反应;③有可能是置换反应;④不可能有分子参加;⑤一定为氧化还原反应或复分解反应,其中正确的是( )
| A. | ③⑤ | B. | 只有③ | C. | ③④⑤ | D. | ①③④ |
2.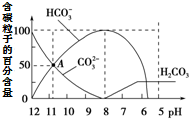 常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
 常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )| A. | 0.1 mol•L-1 Na2CO3溶液中:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+) | |
| B. | A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 0.05 mol•L-1 NaHCO3溶液的pH=8 | |
| D. | pH=7时混合液中c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-) |
12.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 7.8gNa2O2中所含有的阴离子数目是0.2NA | |
| B. | 标准状况下,2.24L18O2中含有的中子的数目是NA | |
| C. | 在20℃、1.01×105 Pa时,2.8g C2H4和CO的混合气体含气体分子数是0.1 NA | |
| D. | 标准状况下,a L CH4和a L C6H14中所含分子数均约为$\frac{a{N}_{A}}{22.4}$ |
16.室温下,在某NaHSO4溶液中离子的总浓度为0.6mol/L,若向其中加入等体积离子总浓度为0.6mol/L的Ba(OH)2,下列说法不正确的是( )
| A. | NaHSO4溶液中c(Na+)=c(OH-)+c(HSO${\;}_{4}^{-}$)+2c(SO${\;}_{4}^{2-}$) | |
| B. | 混合后溶液pH值为13 | |
| C. | 混合溶液中c(Ba2+)+c(Na+)+c(H+)=c(SO${\;}_{4}^{2-}$)+c(OH-) | |
| D. | 加入Ba(OH)2溶液后混合溶液水电离程度比纯水的小 |
6.25℃时,浓度相同的Na2CO3和NaHCO3溶液,下列判断不正确的是( )
| A. | 粒子种类不相同 | B. | c(OH-)前者大于后者 | ||
| C. | 均存在电离平衡和水解平衡 | D. | 分别加入NaOH固体,c(CO32-)均增大 |