题目内容
2. 常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )
常温下在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中含碳粒子的百分含量随pH的变化如图所示.下列说法不正确的是( )| A. | 0.1 mol•L-1 Na2CO3溶液中:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+) | |
| B. | A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 0.05 mol•L-1 NaHCO3溶液的pH=8 | |
| D. | pH=7时混合液中c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-) |
分析 A.0.1 mol•L-1 Na2CO3溶液中存在质子守恒,氢离子总浓度和氢氧根离子总浓度相同;
B.A点时:c(CO32-)和c(HCO3-)相同,溶液显碱性;
C.c(HCO3-)=100%时,溶液的pH=8,溶液显碱性,碳酸氢根离子水解程度大于其电离程度;
D.溶液中电荷守恒分析判断.
解答 解:A.0.1 mol•L-1 Na2CO3溶液中存在质子守恒,氢离子总浓度和氢氧根离子总浓度相同,c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+),故A正确;
B.由图象可知,A点时:c(CO32-)和c(HCO3-)相同,溶液显碱性,则c(Na+)>c(CO32-)═c(HCO3-)>c(OH-)>c(H+),故B错误;
C.0.05 mol•L-1 NaHCO3溶液碳中酸氢根离子水解程度大于其电离程度,c(HCO3-)=100%时,溶液的pH=8,说明0.05mol/L NaHCO3溶液的pH=8,故C正确;
D.在20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HCl溶液40mL,溶液中在电荷守恒为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),pH=7时混合液中c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-),故D正确;
故选B.
点评 本题考查溶液离子浓度大小比较、离子反应、溶液中守恒关系的应用等问题,题目难度中等,注意分析图象曲线变化趋势,把握物质的性质.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
12.下列说法不正确的是( )
| A. |  的分子式为C17H24O3 的分子式为C17H24O3 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙炔 | |
| C. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH | |
| D. | 完全燃烧等质量的甲醛、乙酸、葡糖糖、蔗糖消耗的氧气量相等 |
13.在实验室里可按图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是( )


| A. | HCl | B. | Cl2 | C. | NH3 | D. | CO |
10.下列物质中属于酸性氧化物的是( )
| A. | NO2 | B. | SO2 | C. | Al2O3 | D. | Fe2O3 |
7.下列叙述中正确的是( )
| A. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 3.4 g NH3中含N-H键数目为0.2NA | |
| C. | 电解精炼铜的过程中,粗铜与电源的负极相连 | |
| D. | CaC2阴阳离子的数目比为1:2 |
14.下列说法正确的是( )
| A. | 原子序数相差8的两种短周期元素,其周期序数必相差1 | |
| B. | 氢化锂三兄弟-LiH、LiD、LiT三种物质的质子数之比为4:5:6 | |
| C. | 除零族元素外,短周期元素的最高正价在数值上都等于该元素所属的族序数 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
11.实验盒中有7种没有标签的溶液,老师让化学实验小组同学鉴别这些溶液.
(1)调查研究:
①实验盒中记录单上登记的7种溶液是:KMnO4、Na2CO3、CuSO4、NaCl、Ca(OH)2、NaOH和稀盐酸,其中有颜色的是KMnO4和CuSO4 溶液.
②查阅资料:无色有刺激性气味的氯化氢气体溶于水得到盐酸.
(2)提出假设:同学们从5种无色溶液中取出4种,贴上A、B、C、D标签,并且假设这一组溶液是Na2CO3、NaCl、Ca(OH)2和稀盐酸.
(3)实验探究:同学们按以下步骤进行鉴别.
【第一步】取4支试管,分别加入少量的A、B、C、D溶液,然后依次加入少量盐酸,实验现象记录如下:
实验结论:C是Na2CO3溶液.
【第二步】依据图1装置进行实验,其中夹持固定装置已略去.从长颈漏斗加入盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化.
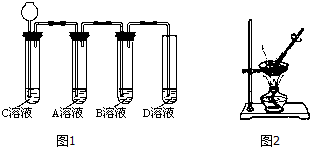
实验解释:A溶液中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
C溶液中发生反应的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O
【第三步】依据图2装置进行2个实验.取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热.再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热.
实验结论:B是稀盐酸,D是NaCl溶液.
经过上述三步实验,同学们认为第5种无色溶液是NaOH溶液.
(4)实验反思:老师引导同学们讨论了上述实验探究过程.进行了全面反思.
友情提示:鉴别出C溶液后,不需外加试剂,就可以简便地鉴别出A、B溶液.用C溶液简便地鉴别出A、B溶液的方法是:取少量C分别滴入盛有A和B的试管中,A中有白色沉淀产生,A是Ca(OH)2溶液,B中有气泡产生,则可鉴别出B.
(1)调查研究:
①实验盒中记录单上登记的7种溶液是:KMnO4、Na2CO3、CuSO4、NaCl、Ca(OH)2、NaOH和稀盐酸,其中有颜色的是KMnO4和CuSO4 溶液.
②查阅资料:无色有刺激性气味的氯化氢气体溶于水得到盐酸.
(2)提出假设:同学们从5种无色溶液中取出4种,贴上A、B、C、D标签,并且假设这一组溶液是Na2CO3、NaCl、Ca(OH)2和稀盐酸.
(3)实验探究:同学们按以下步骤进行鉴别.
【第一步】取4支试管,分别加入少量的A、B、C、D溶液,然后依次加入少量盐酸,实验现象记录如下:
| 溶液 | A | B | C | D |
| 加入盐酸后的现象 | 无明显变化 | 无明显变化 | 有气泡产生 | 无明显变化 |
【第二步】依据图1装置进行实验,其中夹持固定装置已略去.从长颈漏斗加入盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化.

实验解释:A溶液中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
C溶液中发生反应的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O
【第三步】依据图2装置进行2个实验.取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热.再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热.
实验结论:B是稀盐酸,D是NaCl溶液.
经过上述三步实验,同学们认为第5种无色溶液是NaOH溶液.
(4)实验反思:老师引导同学们讨论了上述实验探究过程.进行了全面反思.
友情提示:鉴别出C溶液后,不需外加试剂,就可以简便地鉴别出A、B溶液.用C溶液简便地鉴别出A、B溶液的方法是:取少量C分别滴入盛有A和B的试管中,A中有白色沉淀产生,A是Ca(OH)2溶液,B中有气泡产生,则可鉴别出B.
1. 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)卡片中记录合理的是③④⑥(填序号).
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)在实验中铜片上有气泡产生原因是锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气.
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极(填“锌极”或“铜极”),原因是Cu2++2e-=Cu(用电极方程式表示).
 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| ①Zn为正极,Cu为负极; ②H+向负极移动; ③Cu极有H2产生; ④电子流动方向Zn→G→Cu; ⑤正极的电极反应式是Zn-2e-=Zn2+: ⑥若有1mol电子流过导线,则理论上产生0.5mol H2. |
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)在实验中铜片上有气泡产生原因是锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气.
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极(填“锌极”或“铜极”),原因是Cu2++2e-=Cu(用电极方程式表示).
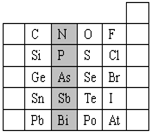 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.