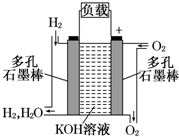
题目内容
6.25℃时,浓度相同的Na2CO3和NaHCO3溶液,下列判断不正确的是( )| A. | 粒子种类不相同 | B. | c(OH-)前者大于后者 | ||
| C. | 均存在电离平衡和水解平衡 | D. | 分别加入NaOH固体,c(CO32-)均增大 |
分析 A.根据电离方程和水解方程判断;
B.碳酸根的水解程度大于碳酸氢根,水解规律:谁强显谁性;
C.任何溶液中均存在水的电离平衡,在水溶液中碳酸氢根离子存在电离平衡和水解平衡;
D.分别加入NaOH固体会抑制Na2CO3的水解,与NaHCO3反应生成Na2CO3.
解答 解:A.NaHCO3溶液中:H2O?H++OH-,HCO3-?CO32-+H+,H2O+HCO3-?H2CO3+OH-;Na2CO3溶液中:H2O?H++OH-,H2O+CO32-?HCO3-+OH-,H2O+HCO3-?H2CO3+OH-,所以存在的粒子种类相同,故A错误;
B.碳酸根的水解程度大于碳酸氢根,二者水解均显碱性,跟据水解规律:谁强显谁性,所以碳酸钠中的氢氧根浓度大于碳酸氢钠溶液中的氢氧根浓度,故B正确;
C.Na2CO3溶液中存在水的电离平衡和碳酸根的水解平衡,NaHCO3在水溶液中存在碳酸氢根的电离平衡和水解平衡以及水的电离平衡,故C正确;
D.分别加入NaOH固体会抑制Na2CO3的水解,与NaHCO3反应生成Na2CO3,则两种溶液中c(CO32-)均增大,故D正确.
故选A.
点评 本题考查了水的电离、盐的水解,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握水解方程式的书写方法、以及影响盐的水解的因素.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
7.下列叙述中正确的是( )
| A. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 3.4 g NH3中含N-H键数目为0.2NA | |
| C. | 电解精炼铜的过程中,粗铜与电源的负极相连 | |
| D. | CaC2阴阳离子的数目比为1:2 |
8. 已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
 已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )| A. | 2mol氢气与1mol氧气的总能量为1368kJ | |
| B. | 形成1molH-O键需要吸收463kJ的能量 | |
| C. | 氢气与氧气反应的热化学方程式为2H2+O2═2H2O△H=-484kJ•mol-1 | |
| D. | 1mol氢气与0.5mol氧气反应生成1mol液态水放热大于242kJ |
1. 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)卡片中记录合理的是③④⑥(填序号).
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)在实验中铜片上有气泡产生原因是锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气.
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极(填“锌极”或“铜极”),原因是Cu2++2e-=Cu(用电极方程式表示).
 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| ①Zn为正极,Cu为负极; ②H+向负极移动; ③Cu极有H2产生; ④电子流动方向Zn→G→Cu; ⑤正极的电极反应式是Zn-2e-=Zn2+: ⑥若有1mol电子流过导线,则理论上产生0.5mol H2. |
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)在实验中铜片上有气泡产生原因是锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气.
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极(填“锌极”或“铜极”),原因是Cu2++2e-=Cu(用电极方程式表示).
11.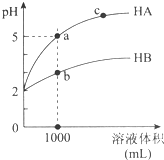 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )| A. | HA的酸性比HB的酸性弱 | |
| B. | a点溶液的导电性比c点溶液的导电性弱 | |
| C. | 若两溶液无限稀释,则它们的c(H+)相等 | |
| D. | 对a、b两点溶液同时升高温度,则$\frac{c({A}^{-})}{{c(B}^{-})}$增大 |
15.某强酸性溶液X可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
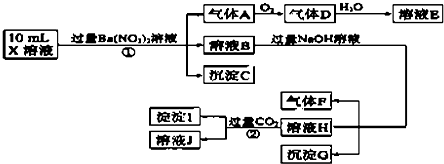
测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,沉淀C物质的量小于0.7mol,根据以上信息,下列说法正确的是( )

测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,沉淀C物质的量小于0.7mol,根据以上信息,下列说法正确的是( )
| A. | 由实验①可知,气体A一定是NO,沉淀C一定是BaSO4,原溶液中肯定含有SO32- | |
| B. | 溶液E和气体F不能发生化学反应 | |
| C. | 由实验 ②可知,沉淀I可能是Al(OH)3和BaCO3 | |
| D. | 原溶液中肯定含有Al3+、NH4+、Fe2+、SO42-、Cl-,不能确定是否含有Fe3+ |
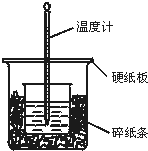 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: .
.